
【题目】设NA是阿伏加德罗常数的值。下列说法错误的是
A.1 L 0.1 mol/L NH4 NO3溶液中含有氮原子总数为0.2 NA
B.7.8 g Na2 O2与水完全反应,转移的电子数为0.2 NA
C.2.8 g CO和N2混合气体中含有质子数为1.4 NA
D.标准状况下,2. 24 L环丙烷中化学键数目为0.9 NA
【答案】B
【解析】
A.1 L 0.1 mol/L NH4NO3溶液中含有0.1mol NH4NO3,含有氮原子总数为0.2NA,故A正确;
B.7.8 g Na2O2的物质的量为![]() =0.1mol,与水反应的方程式为2Na2O2+ 2H2O = 4NaOH + O2↑,反应中只有Na2O2中O元素的化合价发生变化,反应中转移2个电子,因此0.1molNa2O2完全反应转移的电子数为0.1NA,故B错误;
=0.1mol,与水反应的方程式为2Na2O2+ 2H2O = 4NaOH + O2↑,反应中只有Na2O2中O元素的化合价发生变化,反应中转移2个电子,因此0.1molNa2O2完全反应转移的电子数为0.1NA,故B错误;
C.CO和N2的摩尔质量都是28g/mol,2.8 g CO和N2混合气体的物质的量为0.1mol,CO和N2分子中含有的质子数都是14,则2.8 g CO和N2混合气体中含有质子数为1.4NA,故C正确;
D.标准状况下,2. 24 L环丙烷的物质的量=![]() =0.1mol,1个环丙烷分子中含有6个C-H和3个C-C,化学键总数为9,因此0.1mol环丙烷中化学键数目为0.9NA,故D正确;
=0.1mol,1个环丙烷分子中含有6个C-H和3个C-C,化学键总数为9,因此0.1mol环丙烷中化学键数目为0.9NA,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是
A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯化物种数最少的是丙 D. 甲中所有原子一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所得判断正确的是( )
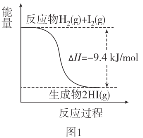
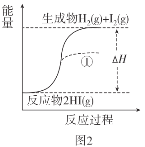
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
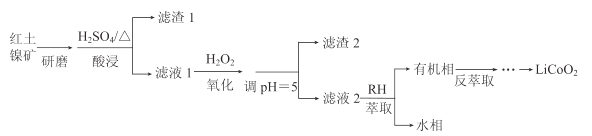
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
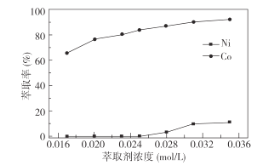
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原氮氧化物可防止空气污染。向1L密闭容器加入一定量的活性炭和NO,某温度下发生反应:
已知:①C(s)+2NO(g)![]() N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
②C(s)+O2(g)![]() CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g)![]() 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol
下列说法错误的是
A.ΔH= -574.0 kJ/mol
B.当容器内气体密度不变时,反应①达到平衡状态
C.反应③正反应的活化能大于180.5 kJ/mol
D.反应①达到平衡后,增大压强平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:
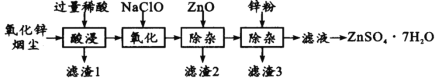
有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤常温下,分别取滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入过量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入过量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入过量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为原料合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PASNa)的路线如下:
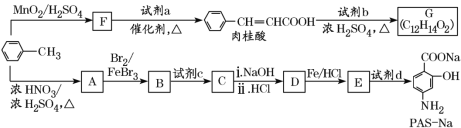
已知:①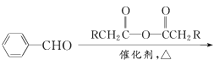
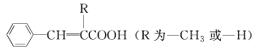
②![]()
③![]()
回答下列问题:
(1)肉桂酸中所含官能团的名称是______________。
(2)①试剂a的结构简式是________________。
②写出由A生成B的化学方程式:____________________。
(3)已知试剂b为相对分子质量为60的醇,且无支链,写出G的结构简式:________________,由肉桂酸制取G的反应类型是________。
(4)①当试剂d过量时,可以选用的试剂d是_____(填字母)。
a.NaOH b.Na2CO3 c.NaHCO3
②参照题中信息,设计以![]() 为起始原料制备
为起始原料制备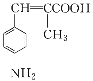 的合成路线。
的合成路线。
____________________。
(5)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有________种。写出其中一种处于对位且核磁共振氢谱中比例为6:1:2:2:1的结构简式______________________________。
a.苯环上有两个取代基
b.能发生银镜反应
c.与Na作用有H2产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com