
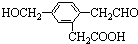
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ①③④⑤⑥ |
科目:高中化学 来源: 题型:解答题
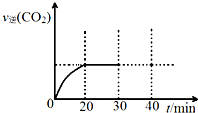 消除大气污染有多种方法.
消除大气污染有多种方法.| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | Fe2O3 | C. | CO2 | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4I的电子式: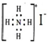 | |
| B. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| C. | 钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比不同 | |
| D. | Al2O3的化学键类型与AlCl3的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
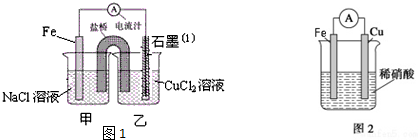
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 在Mg(OH)2、Al(OH)3中分别加入稀氨水,观察沉淀能否溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com