
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe + NO3- + 10H+ = 4Fe2+ + NH4+ + 3H2O。
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低。课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是 (化学式)。
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响。
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1 mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等。
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定 (要求所测得的数据能直接体现反应速率大小)。
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示)。
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
物理量 实验序号 | V(2.0mol/L KNO3)/ mL | …… | |
1 | a | …… | |
2 | a | …… | |
3 | a | …… |
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是 。
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:选择题
某学生以铁丝和Cl2为原料进行下列三个实验。
从分类角度下列分析正确的是
A.实验①、③反应制得的物质均为纯净物
B.实验②、③均未发生氧化还原反应
C.实验②、③均为放热反应
D.实验①、②所涉及的物质均为电解质或非电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:实验题
(16分)氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是______________________________________________________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
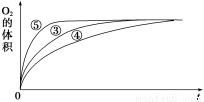
分析该图能够得出的实验结论是_________________________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
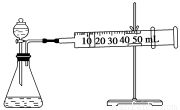
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。
请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
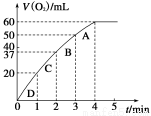
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):
a. ;b. 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | H2O2、SO2都能使酸性高锰酸钾溶液褪色 | 前者表现出还原性后者表现出漂白性 |
B | 纯银器表面在空气中渐渐变暗 | 发生化学腐蚀 |
C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:选择题
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是
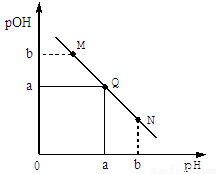
A.Q点消耗氨水溶液的体积等于HCl溶液的体积
B.M点所示溶液导电能力弱于Q点
C.M点和N点所示溶液中水的电离程度相同
D.N点所示溶液中c(NH4+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:推断题
【化学—选修5有机化学基础】石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:
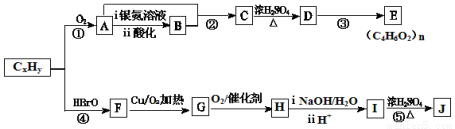
已知:Ⅰ.下列反应中R、R′代表烃基
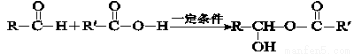
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____。
(2)H的分子式是 。
(3)下列说法正确的是 。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出两种符合条件K的结构简式____。
(5)写出反应⑤的化学方程式______________。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
工业上用DME法以H2和CO为原料生产甲醚(CH3 OCH3)。其原理是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是
温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
A.反应①、②均为吸热反应
B.290℃时反应②平衡常数值达到最大
C.平衡时,反应①与②中CH3OH的消耗速率一定相等
D.增大压强能增大CH3OCH3产率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:填空题
( 16分)下图表示几种无机物之间的转化关系.其中A 、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.
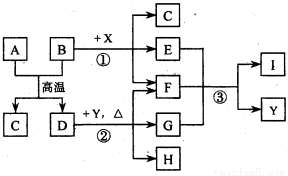
请回答下列问题:
(l)A的化学式是_____________,C 的电子式是_______________,Y 的名称是_______________.
(2)反应① 的化学方程式为______________________________________.
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)_______________ _____________________.
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是____________ ______.
(5)推测反应③ 的还原产物可能是______________________.
(6)19.2 g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com