
分析 (1)氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现;二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质,加热会恢复原来的颜色,Cl2和SO2在水溶液中按1:1反应生成硫酸和氯化氢,由于二氧化硫恰好反应,所以品红不会褪色;
(2)200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=$\frac{m}{M}$计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.
解答 解:(1)氯气与水反应生成次氯酸,次氯酸使品红溶液褪色,Cl2和SO2等物质的量混合发生反应Cl2+SO2+2H2O=H2SO4+2HCl,离子反应为SO2+Cl2+2H2O═4H++SO42-+2Cl-,Cl2和SO2按1:1恰好反应,所以品红不会褪色,
故答案为:品红溶液褪色;品红不褪色;SO2+Cl2+2H2O═4H++SO42-+2Cl-;
(2)200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=$\frac{8g}{32g/mol}$=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:$\frac{11.6g}{0.5mol}$=23.2g/mol,所以混合气体的平均相对分子质量为23.2,故答案为:23.2.
点评 本题考查了Cl2和SO2起漂白和有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
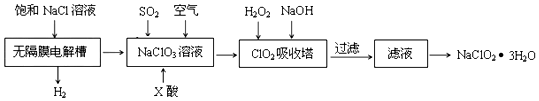
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③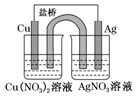 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的盐酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能减小 | |
| C. | 浓度均为0.1mol•L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>NaHCO3>(NH4)2SO4>NH4Cl | |
| D. | 为确定H2A是强酸还是弱酸,可测0.1mol•L-1NaHA溶液的pH,若pH>1,则H2A是弱酸;若pH=1,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )| A. | 浓HNO3、P4(白磷) | B. | 乙醇、汞液 | ||
| C. | 氯水、KClO3 | D. | 双氧水、“84”消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符合条件 | 对应物质 |
| 混合物 | |
| 电解质,但熔融状态下不导电 | |
| 电解质,但难溶于水 | |
| 单质,本身能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com