
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 硝酸银溶液中滴入食盐水:Cl-+Ag+═AgCl↓ | |
| D. | 稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
分析 A.稀硫酸具有弱氧化性,将Fe氧化为亚铁离子;
B.电荷不守恒、转移电子不守恒;
C.二者发生复分解反应生成AgCl沉淀;
D.碳酸钙和稀盐酸反应生成钙离子、二氧化碳和水.
解答 解:A.稀硫酸具有弱氧化性,将Fe氧化为亚铁离子,离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.电荷不守恒、转移电子不守恒,离子方程式为Cu+2Ag+═Cu2++2Ag,故B错误;
C.二者发生复分解反应生成AgCl沉淀,离子方程式为Cl-+Ag+═AgCl↓,故C正确;
D.碳酸钙和稀盐酸反应生成钙离子、二氧化碳和水,离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子方程式正误判断,为高频考点,明确离子反应实质、离子性质是解本题关键,知道哪些物质写化学式、哪些物质写离子,易错选项是A.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用于呼吸面具中作为氧气来源 | |
| B. | 明矾溶于水最终可形成的Al(OH)3胶体,能吸附水中悬浮物以净化水 | |
| C. | 可用Na2CO3 治疗胃酸过多 | |
| D. | 铝制餐具不宜长期存放酸性、碱性或咸的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol硫酸 | |
| B. | 1 L溶液中含1 mol H+ | |
| C. | 将98 g硫酸溶于1 L水所配成的溶液 | |
| D. | 从1 L溶液中取出500 mL后,剩余溶液的浓度仍为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CO、O2、CaO | B. | O2、CO、CO2、CaCO3 | C. | O2、CO2、CO、CaCO3 | D. | CO、CO2、O2、Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
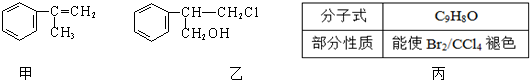
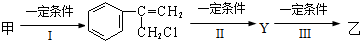
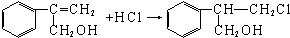 (不需注明反应条件).
(不需注明反应条件).
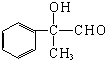 ;丙的结构简式为
;丙的结构简式为 .
. 、
、 、
、 其中一种.
其中一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
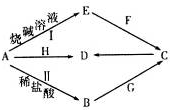
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
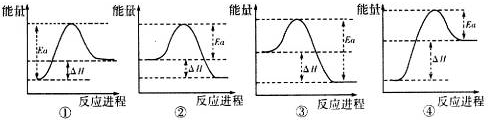
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com