
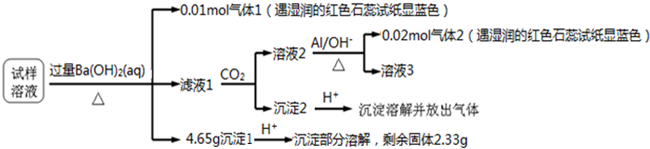
| A. | 沉淀2为氢氧化铝 | |
| B. | Cl-一定存在,且c(Cl?)≥0.05mol | |
| C. | 该试样溶液中一定存在的离子有NH4+、Mg2+、Al3+、SO42-和NO3- | |
| D. | 试样中可能存在Na+、Cl-、Al3+ |
分析 试样溶液中加入过量Ba(OH)2并加热,生成的气体1,该气体1可能是NH3,则试样中含有NH4+,物质的量是0.01mol,向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,3NO3-+8Al+5OH-+2H2O=3NH3+8AlO2-,生成气体2,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-,氨气的物质的量是0.02mol,含有硝酸根离子是0.02mol,滤液1中通入CO2,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有SO42-,能和过量Ba(OH)2反应生成能溶于酸的沉淀,根据离子知,该沉淀为Mg(OH)2,氢氧化镁和硫酸钡一共是4.65g,硫酸钡沉淀是2.33g,即0.01mol,所以氢氧化镁是2.32g,物质的量是所以溶液中含有Mg 2+0.04mol,结合题给选项分析解答.
解答 解:试样溶液中加入过量Ba(OH)2并加热,生成的气体1,该气体1可能是NH3,则试样中含有NH4+,物质的量是0.01mol,向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,3NO3-+8Al+5OH-+2H2O=3NH3+8AlO2-,生成气体2,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-,氨气的物质的量是0.2mol,含有硝酸根离子是0.2mol,滤液1中通入CO2,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有SO42-,能和过量Ba(OH)2反应生成能溶于酸的沉淀,根据离子知,该沉淀为Mg(OH)2,氢氧化镁和硫酸钡一共是4.65g,硫酸钡沉淀是2.33g,即0.1mol,所以氢氧化镁是2.32g,物质的量是所以溶液中含有Mg 2+0.04mol,据以上分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,根据电荷守恒,得到阳离子电荷数之和:0.01mol+0.04mol×2=0.09mol,阴离子电荷物质的量之和:0.01mol×2+0.02mol=0.04mol,一定含有氯离子,
A、沉淀2为碳酸钡等难溶性碳酸盐,故A错误;
B、根据电荷守恒,得到阳离子电荷数之和:0.01mol+0.04mol×2=0.09mol,阴离子电荷物质的量之和:0.01mol×2+0.02mol=0.04mol,一定含有氯离子Cl-,且c(Cl?)≥0.05mol,故B正确;
C、根据以上分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,根据实验操作不能确定是否含有Al3+,即试样中可能含有Al3+,故C错误;
D.根据实验无法确定是否含有Na+、Al3+,所以溶液中可能含有Na+、Al3+,故D错误.
故选B.
点评 本题考查了物质的推断,明确物质的性质及特殊反应现象是解本题关键,根据物质的溶解性、物质的性质及题给信息来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否有丁达尔效应,可将分散系分为溶液、胶体和浊液 | |
| B. | 含有最高价元素的化合物一定具有强氧化性 | |
| C. | NH3、SO2、SO3都是非电解质,氯化钠溶液、硫酸铜溶液都是电解质 | |
| D. | Na2CO3、NaHCO3、SiO2的俗称分别为纯碱、小苏打、硅石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得电子被还原,阴离子只能失电子被氧化 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 已知还原性:B->C->D-,反应 2C-+D2═2D-+C2 和反应 2C-+B2═2B-+C2 都能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )
MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )| A. | 在x点,由HO电离出的c (H+)相等,c (M+)=c (R+) | |
| B. | 稀释前,c (ROH)=10 c (MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c (Cl-)>c (M+)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 2.9×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液①C(CH3COONa) ②C(NaClO) ③C(NaHCO3) ④C(Na2CO3)pH关系为:④>②>③>① | |
| B. | 少量CO2通入次氯酸钠溶液中:CO2+ClO-+H2O═HClO+HCO3- | |
| C. | 新制氯水中Cl2+H2O?HCl+HClO为适当增大HClO 的浓度,可加入少量固体Na2CO3 | |
| D. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.448L | B. | 0.672L | C. | 0.896L | D. | 1.344L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com