
有关电化学说法错误的是
A.1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热
B.等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多
C.水中的钢闸门连接电源的负极,属于外加电流的阴极保护法
D.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
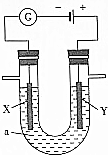 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
【选做题——物质结构与性质】
早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个___________个未成对电子。Fe3+的电子排布式为_____________ 。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为__________,1 mol乙醛分子中含有的σ键的数目为______________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=_____________(填数值);氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
某无色溶液可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4- 中的几种。为确定其成分做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+ 、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有Al3+、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子
B.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
C.标准状况下,11.2 L HF含有0.5 NA个HF分子
D.500mL 12mol.L-1的盐酸与足量 MnO2加热充分反应,生成Cl2 分子数目1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应的速率相等且不为0 | B. | 反应体系中的气体压强保持不变 | ||
| C. | 正、逆反应都还在继续进行 | D. | 反应混合物中各组分的浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com