【答案】
分析:(1)电子总数为10个电子的微粒有:分子:CH
4、NH
3、H
2O、HF、Ne; 阴离子:N
3-、O
2-、F
-、OH
-、NH
2-; 阳离子:Na
+、Mg
2+、Al
3+、NH
4+、H
3O
+;
电子总数为18个电子的微粒有:SiH
4、PH
3、H
2S、HCl、Ar、CH
3-CH
3、NH
2-NH
2、HO-OH、CH
3-OH、H
2N-OH、F
2;阴离子:S
2-、O
22-、Cl
-、HS
-; 阳离子:K
+、Ca
2+、N
2H
5+、N
2H
62+;
根据题意,A、B、C、D含有10e
-离子,E为双核18e
-离子.A与B形成的化合物甲中既有离子键又有共价键,10e
-离子中形成的化合物甲既有离子键又有共价键,可能为氨盐或氢氧化物.A与C结合成的化合物乙难溶于水,10e
-离子中结合成难溶于水的化合物有Mg(OH)
2、Al(OH)
3.再根据乙溶于甲的水溶液得无色透明溶液,即可推出甲、乙、A、B、C;
(2)水的电离为H
2O+H
2O

OH
-+H
3O
+.即可得D,并写出电子式;
(3)A是OH
-,D是H
3O
+,结合成化合物丁,因此丁为H
2O.B是Na
+,B与E形成的化合物丙,其中离子数之比为2:1,E可能为S
2-或O
22-,丁与丙反应产生无色无味气体,即可确定化合物丙,再进一步确定出E;
(4)根据信息分析出戊为18电子微粒中的NH
2-NH
2,写出电子式即可.
解答:解:(1)电子总数为10个电子的阴离子:N
3-、O
2-、F
-、OH
-、NH
2-; 阳离子:Na
+、Mg
2+、Al
3+、NH
4+、H
3O
+.
电子总数为18个电子的阴离子:S
2-、O
22-、Cl
-、HS
-; 阳离子:K
+、Ca
2+、N
2H
5+、N
2H
62+.
根据题意,A、B、C、D含有10e
-离子,E为双核18e
-离子.A与B形成的化合物甲中既有离子键又有共价键,10e
-离子中形成的化合物甲既有离子键又有共价键,可能为氨盐或氢氧化物.A与C结合成的化合物乙难溶于水,10e
-离子中结合成难溶于水的化合物有Mg(OH)
2、Al(OH)
3.再根据乙溶于甲的水溶液得无色透明溶液,确定乙为Al(OH)
3,甲为强碱NaOH.则A为OH
-,B为Na
+,C为Al
3+.故C的离子结构示意图为

,Al(OH)
3和NaOH反应生成NaAlO
2和H
2O,反应方程式为Al(OH)
3+NaOH═NaAlO
2+2H
2O,改写离子方程式时,Al(OH)
3难溶于水需保留化学式,NaOH、NaAlO
2都易溶于水易电离需改成离子形式,H
2O为弱电解质需保留化学式.可得Al(OH)
3+Na
++OH
-═Na
++AlO
2-+2H
2O,删除Na
+,
故离子方程式为Al(OH)
3+OH
-=AlO
2-+2H
2O,
故答案为:
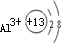
;Al(OH)
3+OH
-=AlO
2-+2H
2O;
(2)水的电离为H
2O+H
2O

OH
-+H
3O
+.即可得A为OH
-,D为H
3O
+,D为复杂阳离子,其电子式要加方括号,并标明所带电荷,故D电子式为
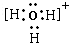
,
故答案为:
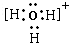
;
(3)根据题意,A是OH
-,D是H
3O
+,结合成化合物丁,因此丁为H
2O.B是Na
+,B与E形成的化合物丙,其中离子数之比为2:1,E可能为S
2-或O
22-,又因为丁与丙反应产生无色无味气体,所以丙只能为Na
2O
2,方程式为2Na
2O
2+2H
2O═4NaOH+O
2↑.H
2O是共价化合物,O原子和H原子之间通过共用电子对形成共价键,故电子式为
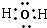
,
故答案为:
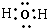
;2Na
2O
2+2 H
2O=4 NaOH+O
2↑;
(4)根据题意,化合物戊为液态氮氢化合物,同时也为18电子,N原子核外有7个电子,H原子核外有1个电子,因此化合物戊中应含2个N原子和4个H原子,故化学式为N
2H
4,结构分析得到该分子中只含有单键,所以氮原子和氮原子、氢原子和氢原子之间都是形成一对共用电子对,故电子式为
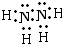
,
故答案为:
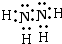
.
点评:本题考查10电子和18电子微粒、电子式、结构示意图和离子方程式.熟记10电子和18电子微粒是解题基础,电子式的书写是关键,注意阳离子、阴离子、共价化合物、离子化合物的电子式的书写.

 OH-+H3O+.即可得D,并写出电子式;
OH-+H3O+.即可得D,并写出电子式; ,Al(OH)3和NaOH反应生成NaAlO2和H2O,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O,改写离子方程式时,Al(OH)3难溶于水需保留化学式,NaOH、NaAlO2都易溶于水易电离需改成离子形式,H2O为弱电解质需保留化学式.可得Al(OH)3+Na++OH-═Na++AlO2-+2H2O,删除Na+,
,Al(OH)3和NaOH反应生成NaAlO2和H2O,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O,改写离子方程式时,Al(OH)3难溶于水需保留化学式,NaOH、NaAlO2都易溶于水易电离需改成离子形式,H2O为弱电解质需保留化学式.可得Al(OH)3+Na++OH-═Na++AlO2-+2H2O,删除Na+,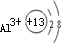 ;Al(OH)3+OH-=AlO2-+2H2O;
;Al(OH)3+OH-=AlO2-+2H2O; OH-+H3O+.即可得A为OH-,D为H3O+,D为复杂阳离子,其电子式要加方括号,并标明所带电荷,故D电子式为
OH-+H3O+.即可得A为OH-,D为H3O+,D为复杂阳离子,其电子式要加方括号,并标明所带电荷,故D电子式为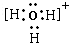 ,
,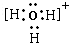 ;
;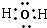 ,
,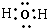 ;2Na2O2+2 H2O=4 NaOH+O2↑;
;2Na2O2+2 H2O=4 NaOH+O2↑;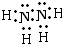 ,
,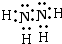 .
.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: