
【题目】下列叙述正确的是
A.40K与40Ca有相同的中子数B.H2与D2互为同位素
C.S2与S8是同素异形体D.16O3的摩尔质量是48
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A.木已成舟B.铁杵成针C.蜡炬成灰D.滴水成冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为_________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。
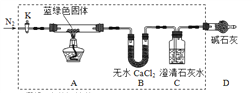
请回答下列问题:
(1)假设2中的沉淀为___________________。
(2)假设1中沉淀为Cu(OH)2的理论依据是(用离子方程式表示)____________。
(3)无水乙醇洗涤的目的_______________________________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明___________成立。(填写“假设1” “假设2”或“假设3”)。
(5)乙同学认为只要将上图中B装置的试剂改用______试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
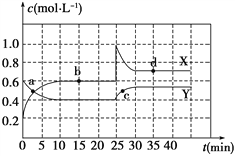
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):____________________。
(2)0~10min化学反应速度V(X)=__________________。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四个点中,表示化学反应处于平衡状态的点是_________,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
(1)有机物M经过太阳光光照可转化为N,转化过程如下: 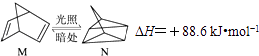
则M、N相比,较稳定的是 .
(2)CO可用于合成燃料甲醇.在有催化剂存在的10L恒容密闭容器中充入2mol CO和4mol H2 , 发生如下反应:CO(g)+2H2(g)CH3OH(g). 测得CO的平衡转化率与温度、压强的关系如图所示:
①判断上述反应达到平衡状态的依据是(填字母编号).
A.CH3OH的生成速率与CO的消耗速率相等
B.CH3OH、CO、H2的浓度都不再发生变化
C.混合气体的密度不变
D.混合气体的相对平均分子质量不变
②下列措施中,能使上述平衡体系中 ![]() 的值增大的是(填字母编号).
的值增大的是(填字母编号).
A.降低温度 B.充入He(g),使体系压强增大 C.再充入1mol CO和2mol H2
③100℃时反应在5min末达到平衡,则从反应开始至达平衡,v(H2)=mol/(Lmin);该温度下反应的平衡常数K= . 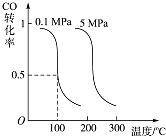
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铅蓄电池是可充电电池,电池的正极材料为PbO2
C.燃料电池是一种高效且对环境友好的新型电池
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
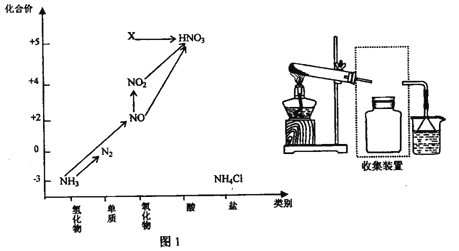
(1)实验窒常用NH4Cl 与Ca(OH)2制取氨气,该反应的化学方程式为___________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在虚框内画出连接图。___________
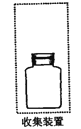
(3)下列试剂不能用手干燥NH3的是_________。
A.浓硫酸 B.碱石灰 C.NaOH 固体
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO 化学方程式为____________。
②NO→NO2 实验现象是_______ 。
③ NO2![]() HNO3 氧 化剂 与 还原剂物质的量之比为_______。
HNO3 氧 化剂 与 还原剂物质的量之比为_______。
(5)图1中,实验室只用一种物质将NO 直接转化为硝酸且绿色环保,则该物质的化学式为_____________,
(6) 图1中,X的化学式为__________,从物质性质上看,X 属于_______氧化物。
(7)若要将NH3→N2,,从原理上看,下列试剂可行的是_______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的二氧化锰与40 mL10 mol·L-1浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比
A. 两者产生的氯气一样多 B. 前者产生的氯气的量是后者的2倍
C. 后者产生的氯气的量比前者多 D. 后者产生的氯气的量是前者的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2molH2O |
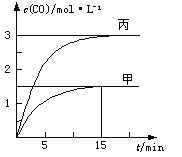
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1℃时,反应的平衡常数K=4.5
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com