
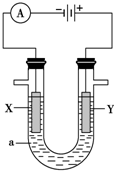
 电解原理在化学工业中有广泛的应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)电解饱和氯化镁时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子,以此解答该题;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极;
(3)电镀时,镀层作阳极,镀件作阴极,含有镀层金属阳离子的盐溶液为电镀液.
解答 解:(1)①和电源的负极相连的电极X极是阴极,阳离子Mg2+、H+移向此电极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,该电极附近氢氧根离子浓度增加,产生氢氧化镁沉淀,故答案为:2H++2e-═H2↑;有气体和沉定生成;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,故答案为:把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极;
①Y电极为电解池的阳极,所以Y电极的材料是粗铜;X电极是阴极,电极材料是纯铜,该电极上发生反应:Cu2++2e-═Cu,
故答案为:纯铜;Cu2++2e-═Cu;
②该电解池的阳极材料是粗铜,参与放电的是金属锌、铁、铜等金属,在阴极上一直是铜离子得电子的还原反应,溶液中的c(Cu2+)与电解前相比减小,故答案为:变小;
(3)铁上镀银时,镀层金属银作阳极,发生反应:Ag-e-═Ag+,镀件金属铁作阴极,含有镀层金属阳离子银离子的盐溶液AgNO3溶液为电镀液,故答案为:Ag-e-═Ag+;AgNO3溶液.
点评 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
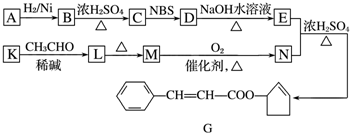
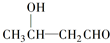
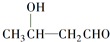 $\stackrel{△}{→}$CH3CH═CHCHO+H2O
$\stackrel{△}{→}$CH3CH═CHCHO+H2O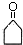 ,G中官能团的名称为碳碳双键和酯基.
,G中官能团的名称为碳碳双键和酯基. ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0~16 h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| B. | 0~25 h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ/mol | |
| B. | 2SO2(g)+O2(g)?SO3(l)△H=-196.6 kJ/mol | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-122.9 kJ/mol | |
| D. | 2SO2(g)+O2(g)?SO3(g)△H=+196.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原物质及杂质 | 除杂试剂 | 主要操作或方法 |
| A | 乙酸乙酯(乙酸) | Na2CO3 | 过滤 |
| B | Na2CO3(s )[NaHCO3(s )] | NaOH溶液 | 转化法 |
| C | FeCl2(CuCl2) | Zn | 过滤 |
| D | 苯(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 0.975 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com