
下列类比关系正确的是
A.AlCl3与过量NaOH溶液反应生成AlO2—,则与过量NH3·H2O反应也生成AlO2—
B.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D.Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
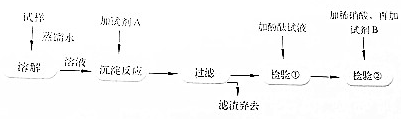
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和HCl | B. | NaCl和Na2CO3 | C. | H2SO4和BaCl2 | D. | NaCl和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:实验题
I.高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制480mL 0.1000 mol·L-1的酸性KMnO4溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 。
②下列操作对实验结果的影响偏大的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶底部有少量蒸馏水
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.天平的砝码生锈
(2)某化学兴趣小组,用新配制的酸性KMnO4溶液来测定某试剂厂生产的FeSO4溶液中Fe2+的物质的量浓度。
①酸性高锰酸钾溶液与FeSO4溶液反应的离子方程式为
②该小组在测定过程中发现,测得的Fe2+的物质的量浓度比标签上的标注值要低,在滴定操作准确的前提下,可能导致该测定结果的原因如下:
猜想一:FeSO4溶液变质;证明方法是
猜想二:
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(1)写出该反应的化学方程式:________________________;
(2)该反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果: 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:选择题
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.整个过程发生了复分解反应和氧化还原反应
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
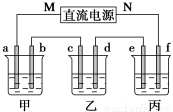
(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______________极;
②电极b上发生的电极反应为_______________;
③电极b上生成的气体在标准状况下的体积为_______________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液______________;乙溶液_____________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液 C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:填空题
(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.断裂3 mol H-H键的同时形成6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中的压强不随时间变化
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com