
����Ŀ����NA��ʾ����٤����������ֵ����ش��������⣺
��1��0.5mol SO2������Լ��ԭ�ӣ�����g SO3������ԭ������ȣ�
��2��������ͬ�Ģ�HCl����NH3����CO2����O2���������У���ͬ��ͬѹ�����£���ռ�����С���ǣ�����ţ� ��
��3��19gij���۽����Ȼ��ACl2���к���0.4mol Cl�� �� ��ACl2��Ħ����������
��4����״����ij��O2��N2�Ļ������m g������b�����ӣ���n g�û����������ͬ״������ռ�����Ӧ�� ��
���𰸡�
��1��1.5NA,40
��2����
��3��95g/mol
��4��![]() L
L
���������⣺��1��������������ԭ�ӷ��ӣ���0.5molSO2�к�1.5molԭ�Ӽ�1.5NA�������ڶ�������ṹ�к�һ��Sԭ�ӣ���0.5mol���������к��е�ԭ��Ϊ0.5mol����������������Ҳֻ��һ��Sԭ�ӣ��ʺ�0.5molSԭ�ӵ�������������ʵ���ҲΪ0.5mol��������m=nM=0.5mol��80g/mol=40g��
���Դ��ǣ�1.5NA��40��
��2��ͬ��ͬѹ����������ʵ��������ȣ�����������ͬʱ�����ʵ�����Ħ�������ɷ��ȣ���������ͬʱ�������Ħ�������ɷ��ȣ�����ռ�������С�ļ�Ħ���������ģ���Ϊ�ۡ�
���Դ��ǣ��ۣ�
��3��19gij���۽������Ȼ���ACl2�к���0.4mol Cl������ACl2�����ʵ���Ϊ��n��ACl2��=0.4mol�� ![]() =0.2mol��ACl2��Ħ������Ϊ��M��ACl2��=
=0.2mol��ACl2��Ħ������Ϊ��M��ACl2��= ![]() =95g/mol��
=95g/mol��
���Դ��ǣ�95g/mol��
��4����������ּ��京����ͬ������������������������ȣ���ng�û�����庬�еķ�����Ϊx����������������ı���ʽΪ��mg��b=ng��x��x= ![]() =
= ![]() ����ng�û�����庬�е����ʵ���Ϊ��n=
����ng�û�����庬�е����ʵ���Ϊ��n= ![]() =
= ![]() =
= ![]() mol���������V=n��Vm =
mol���������V=n��Vm = ![]() mol��Vm =
mol��Vm = ![]() mol��22.4l/mol=
mol��22.4l/mol= ![]() L��
L��
���Դ��ǣ� ![]() L��
L��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݣ�ij��ȤС������ͼ̽��ʵ�飺
��1����ͼ1Ϊijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã���������װ�б��͵�KNO3��Һ�������ƳɵĽ�������NO3������װ�ã���д�����ҡ����������������䣬����CuCl2��Һ��ΪNH4Cl��Һ������������ɫ��ζ�ĵ������壬��ʯī�ϵ缫��Ӧʽ �� 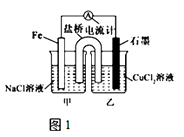
��2����ͼ2�������������䣬�������Ż�����ͭ������ʯī������n�ͣ����װ�������ԭ��ػ���ء�������װ����ʯī��2��Ϊ������װ����������������ʯī��1���缫�Ϸ����ķ�ӦʽΪ �� 
��3����ͼ2��װ���и�Ϊ����CuSO4��Һ��һ��ʱ�����ijһ�缫�������� 1.28g������һ�缫����mL������£����壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ����������ʾ�����ͬһ����ѧ����Ԫ��X����ת����ϵ���£��� ![]() ��
�� ![]() ��������˵������ȷ�ģ� ��
��������˵������ȷ�ģ� ��
A.��AΪ���ᣬXΪ����Ԫ�أ���������Ӧ��������
B.����ΪNaHCO3 �� ���һ����CO2
C.��AΪNaOH��Һ��XΪ�����ڵĽ���Ԫ�أ�����һ��Ϊ��ɫ����
D.��AΪ�������ʣ��ҵ�ˮ��Һ��KSCN��Һ��죬�����Ϊ�ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�������е�����������������ԭ��Ӧ����
A.����������������Ⱦ���γ�����B.ֲ����й������
C.��Ư�۾�ɱ��D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ���Ũ�ȱ�����ȷ���ǣ�������
A.0.2mol/LNa2SO4��Һ�к���Na+��SO42�������ʵ���Ϊ0.6mol
B.��1Lˮ����22.4L�Ȼ��⣨����£����������Ũ����1mol/L
C.10g 98%�����ᣨ�ܶ�Ϊ1.84gcm��3����10mL 18.4mol/L�������Ũ����ͬ
D.50mL 2mol/LNaCl��Һ��100 mL 0.5mol/LMgCl2��Һ�У�Cl�����ʵ���Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
CH3CH2CH2CH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
��CH3��2CHCH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
����˵����ȷ���ǣ� ��
A.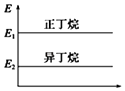
���������춡���������С��ϵ��ͼ
B.��������ȶ��Դ����춡��
C.�춡��ת��Ϊ������Ĺ�����һ�����ȹ���
D.�춡������е�̼�����������Ķ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���CO��g��+2H2��g��CH3OH��g��
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ�� ��
A.����CH3OH������������CO���������
B.���������ܶȲ���
C.��������ƽ����Է�����������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E.�����������ѹǿ���ٸı�
��2�������������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
��д���÷�Ӧ��ƽ�ⳣ��K�ı���ʽ
���ɱ��������жϸ÷�Ӧ�ġ�H0�����������=����������
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У�5minʱ�ﵽƽ�⣬���c��CO��=0.2mol/L����CO��ת����Ϊ �� ��ʱ���¶�Ϊ �� ��0��5min�ڣ���H2��ʾ��ƽ����Ӧ����ΪmolL��1min��1 �� ƽ��ʱCH3OH��Ũ��ΪmolL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
A.һ��Ԫ�ؿ��ж������ӣ���ֻ��һ��ԭ��
B.��ͬ��Ԫ����ɵ��������ڵ���
C.���µ������ɵĻ�ѧ��Ӧ��һ����������ԭ��Ӧ
D.������ͬ��������������ͬ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AԪ�ص�ijͬλ������An-��������x�����ӣ���ͬλ��ԭ�ӵ�������Ϊy�����ԭ�Ӻ��ں��е�������Ϊ
A. y-x+n B. y-x-n C. y+x+n D. y+x-n
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com