
下列说法正确的是
①可用Ba(OH)2溶液同时鉴别AgNO3、AlCl3、NH4Cl、NaCl、Na2SO4五种溶液
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③因为氧化性:HClO>H2SO4,所以非金属性:Cl>S
④胶体的本质特征是丁达尔现象
⑤除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
A.①②⑤ B.①②④ C.②④⑤ D.全部
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
河虾不宜与西红柿同食,主要原因是河虾中含+5价砷,西红柿中含有较多的维生素C,两者同食会产生有毒的+3价砷。据此,下列说法不正确的是
A.该反应中维生素C作还原剂
B.河虾与西红柿同食发生了氧化还原反应
C.该反应中砷元素被氧化
D.河虾与其它含维生素C较多蔬菜也不宜同食
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:填空题
(共8分)过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- + H2O2 + H+ == Mn2+ + H2O + ( )
(3)移取10mL过氧化氢溶液可以用_______(填“酸式”或“碱式”)滴定管。滴定到达终点的现象是____。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果______(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是
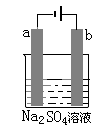
A.逸出气体的体积a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近出现蓝色
D.a电极附近呈蓝色,b电极附近出现红色
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是


A.甲区呈现红色 B.乙区产生Zn2+
C.丙区发生的电极反应式:Cu-2e-= Cu2+ D.丁区呈现蓝色
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:填空题
(12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:选择题
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐和浓硫酸反应制取
C.0.1mol·L-1醋酸钠溶液的pH>7
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的 Ksp = 1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2
C.温度一定时当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com