
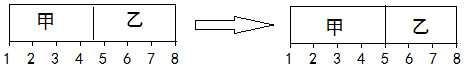
| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
分析 H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,这是一个气体体积不变的反应,故混合气的总物质的量仍为2mol,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,反应后活塞停留在容器的$\frac{4}{7}$处,根据气体的物质的量之比等于体积之比,进行计算一氧化碳与氧气的体积比.
解答 解:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,这是一个气体体积不变的反应,故混合气的总物质的量仍为2mol,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,反应后活塞停留在容器的$\frac{4}{7}$处.根据气体的物质的量之比等于体积之比,设一氧化碳与氧气反应后气体总物质的量为nmol,则$\frac{2mol}{n}=\frac{4}{3}$,则n=1.5mol,
若氧气充足2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2~△n=1mol(注意计算时以不足的作为计算对象)
2 1
1 2-1.5,则n(CO)=1mol,n(O2)=2mol-1mol=1mol,故一氧化碳与氧气的体积比为1:1;
若氧气不足2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2~△n=1mol(注意计算时以不足的作为计算对象)
1 1
0.5 2-1.5,则n(O2)=0.5mol,n(CO)=2mol-0.5mol=1.5mol,故一氧化碳与氧气的体积比为3:1,
故选D.
点评 本题考查了阿伏伽德罗定律及其推论,明确气体体积与物质的量的关系是解本题关键,注意平衡状态时两边容器内压强相等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | B. | 气态氢化物的沸点:Y>W | ||
| C. | Y与W可以形成多种二元化合物 | D. | p、q与r的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取4.8 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
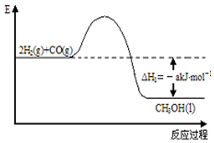 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热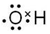 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
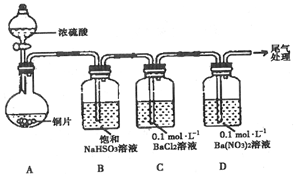
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com