

分析 根据图示可知,A为H、B为C、C为O、D为Na、E为Si、F为S、H为Fe元素,
(1)E的原子序数为14,位于周期表中第二周期ⅣA族;非金属性越强,最高价氧化物对应水合物的酸性越强;
(2)A、D形成的化合物为NaH,属于离子化合物;NaH与水反应生成氢氧化钠和氢气;根据n=$\frac{V}{{V}_{m}}$=$\frac{n}{{N}_{A}}$计算转移电子数;
(3)该溶液为氯化亚铁溶液,亚铁离子易被氧化,配制氯化亚铁溶液时需要加入Fe防止亚铁离子被氧化;双氧水具有强氧化性,能够将氯化亚铁氧化成氯化铁,生成的氯化铁对双氧水的分解具有催化作用,则双氧水中有氧气生成.
解答 解:根据图示可知,A为H、B为C、C为O、D为Na、E为Si、F为S、H为Fe元素,
(1)E为Si元素,位于元素周期表中第三周期第ⅣA族;B、D、E、F四种元素中非金属性最强的为S,则最高价氧化物对应水化物中酸性最强的是H2SO4,
故答案为:第三周期第ⅣA族;H2SO4;
(2)A与D分别为H、Na元素,二者形成的化合物为NaH,NaH中存在的化学键为离子键;NaH溶于水生成氢氧化钠和氢气,反应的离子方程式为:NaH+H2O═Na++OH-+H2↑;标准状况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1mol氢气转移了0.1mol电子,反应中转移电子的总数为0.1NA,
故答案为:离子键;NaH+H2O═Na++OH-+H2↑;0.1;
(3)H为Fe元素,Fe的某种氯化物溶液呈浅绿色,该氯化物为FeCl2,亚铁离子易被氧化,则实验室配制FeCl2溶液时加入少量Fe单质的目的是防止Fe2+被氧化;
向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,双氧水将氯化亚铁氧化成FeCl3,发生反应为:2Fe2++H2O2+2H+═2Fe3++2H2O,溶液变成棕黄色;生成的FeCl3做催化剂使双氧水分解生成氧气,则溶液中有气泡出现,
故答案为:防止Fe2+被氧化;2Fe2++H2O2+2H+═2Fe3++2H2O;2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑ (或2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑).
点评 本题考查位置结构与性质关系的应用,题目难度中等,涉及元素周期律应用、氧化还原反应计算、溶液配制、离子方程式书写等知识,明确原子结构与元素周期表的关系为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素 | |
| D. | M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期现象 |
| 步骤1:实验完成后,将硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为26.0g | |
| 步骤2:将剩余固体加入蒸馏水中 | 有白色沉淀和有刺激性气味的气体生成 |
| 步骤3:用湿润的红色石蕊试纸检验步骤2中生成的气体 | 该气体能使湿润的红色石蕊试纸变蓝 此空删去 |
| 结论:经分析可初步确定猜想丙(填“甲、乙或丙”)是正确的,据此写出Mg与NO2反应的化学方程式7Mg+2NO2$\frac{\underline{\;\;△\;\;}}{\;}$4MgO+Mg3N2. | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4和SiC都属于有机物 | |
| B. | 甲醇和乙酸均能与金属钠反应 | |
| C. | C3H6Cl2的同分异构体有3种 | |
| D. | 若分子式为C5H10O2的酯的水解产物之一为乙醇,则该酯的结构有2种 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
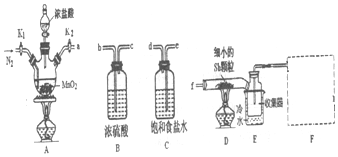
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com