
分别回答下列问题。(10分)
(1)从H+、Na+、Cu2+、Cl-、![]() 中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
①电解过程中溶液颜色变浅且水量不变_______________________;
②电解过程中电解质含量不变,水量减少_______________________;
③电解过程中,两极析出气体的体积比为1∶1__________。
(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体
在标准状况下的体积约为 ;
②用铂电极电解0.02 mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为
(忽略溶液体积的变化) ;
③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ
 C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热
3847kJ,则混合气体中氢气与丙烷的体积比是 。
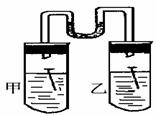
(3)如右图所示,甲、乙两试管中各放一枚铁钉,甲试管中
为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是 ,甲中正极反应为
,负极反应式为,乙中正极反应为 ,负极反应式为 。
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 分别回答下列问题.
分别回答下列问题.| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源:2011届河南省焦作市高三上学期期末考试化学试卷 题型:填空题
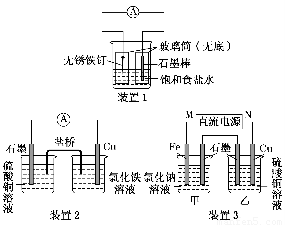
(12分)如图所示3套实验装置,分别回答下列问题:
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g。
①电源的M端为 极,甲烧杯中铁电极的电极反应为 ;
②乙烧杯中电解反应的离子方程式为 ;
③甲、乙两烧杯中生成的气体标准状况下共 mL。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第8讲 电化学基础练习卷(解析版) 题型:填空题
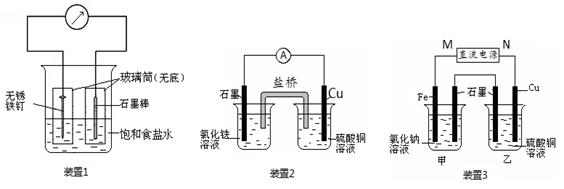
如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为________________________________________________________________________。
(2)装置2中的石墨是________极(填“正”或“负”),该装置发生的总反应的离子方程式为________________________________________________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为________极;甲烧杯中铁电极的电极反应式为_________________。
②乙烧杯中电解反应的离子方程式为_________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高二上学期期末考试化学试卷(解析版) 题型:填空题
(13分)如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液有蓝色沉淀,表明铁被 (填“ 氧化”或“还原”); 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为 极(填“正”或“负”),甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com