
 2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答: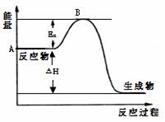
科目:高中化学 来源:不详 题型:填空题
 O2(g)=
O2(g)= P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
| D.H2(g)+1/2O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
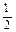 O2(g) =" CO" (g)
O2(g) =" CO" (g) 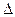 H1= —110.5kJ/mol
H1= —110.5kJ/mol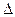 H2= —393.5kJ/mol
H2= —393.5kJ/mol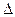 H为
H为| A.+ 283.5kJ/mol | B.+ 172.5kJ/mol |
| C.—172.5kJ/mol | D.—504kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-824.4kJ·mol- 1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 (g)+3H
(g)+3H (g)="==" 2NH
(g)="==" 2NH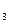 (g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( )
(g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( )| A.431 kJ | B.649kJ | C.945.6kJ | D.869 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
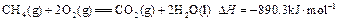 。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )A.283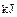 | B.374.4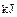 | C.512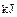 | D.566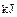 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CH4 ( g )+2NO2 ( g )= N2( g )+C O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 |
| B.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一867 kJ·mol-1 |
C.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一586kJ·mol -1 -1 |
| D.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=+586kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com