
 O2��g���TSO3��g������H=-98.3kJ?mol-1
O2��g���TSO3��g������H=-98.3kJ?mol-1 O2��g���TSO3��g������H=-88.47kJ?mol-1
O2��g���TSO3��g������H=-88.47kJ?mol-1 O2��g���TSO3��g����H=-98.3kJ?mol-1��2SO2��g��+O2��g���T2SO3��g����H=-196.6kJ?mol-1����ѡ��A��
O2��g���TSO3��g����H=-98.3kJ?mol-1��2SO2��g��+O2��g���T2SO3��g����H=-196.6kJ?mol-1����ѡ��A��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2009?̩��ģ�⣩���������dz��õĻ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ�
��2009?̩��ģ�⣩���������dz��õĻ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ�| ���� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?Ϋ��һģ��������Fe2S������SΪ-1�ۣ��ǹ�ҵ�����������Ҫԭ�ϣ�FeS2�ڸ�������������Ӧ��3FeS2+8O2
��2012?Ϋ��һģ��������Fe2S������SΪ-1�ۣ��ǹ�ҵ�����������Ҫԭ�ϣ�FeS2�ڸ�������������Ӧ��3FeS2+8O2
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��19�֣����û�ѧ��Ӧԭ���о��������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
��1�����������У�SO2����������SO3��2SO2��g��+O2��g��2SO3��g���������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺

��2SO2��g��+O2��g��2SO3��g���ġ�H 0���>����<���������ں��¡���
ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ��� ����������
���ڹ̶��ݻ����ܱ������з�����Ӧ����ʼʱSO2��O2�ֱ�Ϊ1mol��0.5mol���ﵽƽ��ʱSO2��ת����Ϊ90�������SO3��ʼ���з�Ӧ������ͬ�����£���ʹƽ��ʱ���ɷֵ����������ǰ����ͬ������ʼʱSO3�����ʵ��� ��ת����Ϊ
�����¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1 K2������Ӧ���е�״
̬Dʱ��
���>������<����=����
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��д����Ȼ��̵��Ļ�ѧ��Ӧ����ʽ�� ��
�ڰ�������ˮ�õ���ˮ����25��C�£���a mol��L-1�İ�ˮ��b mol��L-1������������ϣ���Ӧ����Һ�������ԣ���c��NH4+�� c��Cl-�����>������<����=�������ú�a��b�Ĵ���ʽ��ʾ����ˮ�ĵ���ƽ�ⳣ������ʽ ��
��3����ˮ�к��д�����Ԫ�أ�����Ԫ�����ȡ���Ԫ������ں�ˮ�о��Ի���̬���ڡ���25��C�£���0.1mol��L-1��NaCl��Һ����μ���������0.1mol��L-1��������Һ���а�ɫ�������ɡ���Ӧ�����Һ�У���������0.1mol��L-1��NaI��Һ�������������� �������������ԭ���ǣ������ӷ���ʽ��ʾ�� ��
����֪25��Cʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���������У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ������
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������֪ʶ����������������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ�� ������Ӧ�Ļ�ѧ��ӦΪ��_____________________________
������Ӧ�Ļ�ѧ��ӦΪ��_____________________________
��2������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g�� CH3OH��g������H=��90.8 kJ/mol
CH3OH��g������H=��90.8 kJ/mol
��2CH3OH��g�� CH3OCH3��g��+H2O��g������H=��23.5 kJ/mol
CH3OCH3��g��+H2O��g������H=��23.5 kJ/mol
��CO��g��+ H2O��g��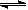 CO2��g��+H2��g������H=��41.3 kJ/mol
CO2��g��+H2��g������H=��41.3 kJ/mol
�ܷ�Ӧ��3H2��g��+3CO��g��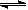 CH3OCH3��g��+CO2��g������H=__________ ��
CH3OCH3��g��+CO2��g������H=__________ ��
�����ѣ�CH3OCH3��ֱ����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ��õ�صĸ�����ӦΪ_____________________________��
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g�� ? H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
? H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
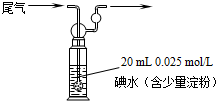
�÷�Ӧ������Ӧ������_________��Ӧ������������������������������500��ʱ���У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020mol/L���ڸ������£�CO��ƽ��ת����Ϊ��________��
��4���Ӱ����������������ᣬ�˹������漰���������NO��NO2��N2O4�ȡ��Է�Ӧ? N2O4��g��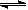 2NO2��g��? ��H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����___________��
2NO2��g��? ��H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����___________��

A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C��B��C����������ƽ����Է���������B��C
D����״̬B��״̬A�������ü��ȵķ���
E��A��C����Ļ�ѧƽ�ⳣ����A��C
��5��NO2���ð�ˮ��������NH4NO3 ��25��ʱ����m mol NH4NO3����ˮ����Һ�����ԣ������Һ�μ�n L��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫______�������������������������������ƶ������μӰ�ˮ��Ũ��Ϊ_______mol��L-1����NH3��H2O�ĵ���ƽ�ⳣ��ȡKb=2X10-5 mol��L-1��
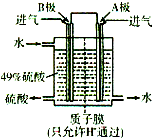
��6��ij���е�λ����ԭ���ԭ������SO2��O2���Ʊ����ᣬװ������ͼ���缫Ϊ��IJ������������壬ͬʱҲ��ʹ������������Һ��ֽӴ���

����Һ��H+���ƶ�������______ ����______��������A��B��ʾ��
��B�缫�ĵ缫��ӦʽΪ__________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com