
| A、Kw | ||
B、
| ||
C、
| ||
| D、c(OH-) |
| c(H+) |
| Ka |
| c(HA) |
| c(A-) |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
| B、1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA |
| C、14g乙烯和环丙烷混合物中含有的碳原子数目为NA |
| D、0.1mol乙炔分子中含有的共用电子对数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25molNa2O2中含有的阴离子数为0.5×6.02×1023 |
| B、7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 |
| C、2.24LCH4中含有的原子数为0.5×6.02×1023 |
| D、250mL2mol/L的氨水中含有NH3?H2O的分子数为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g O2与O3的混合物中含有的氧原子数为0.2NA |
| B、标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
| C、标准状况下,30gNO和16gO2混合所生成的气体分子数为NA |
| D、标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL1 mol?L-1 FeCl3溶液中,阴、阳离子的总数小于0.4 NA |
| B、60gSiO2晶体中含有的Si-O键为4NA |
| C、1molCu在足量的硫蒸气中加热,反应中转移的电子数为NA |
| D、20 g的D2O与NA个CH3-具有相同的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g02和O3的混合气体所含氧原子数在NA/3到NA/2之间 |
| B、62g Na2O与78gNa202含有的离子数均为3NA |
| C、1molC5H12含共价键数为20NA |
| D、1LO.lmol/L的醋酸溶液中所含离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ |
| B、用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C、用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| D、用饱和纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:
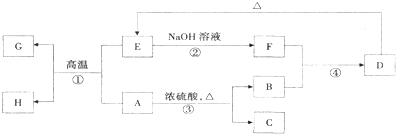
查看答案和解析>>
科目:高中化学 来源: 题型:
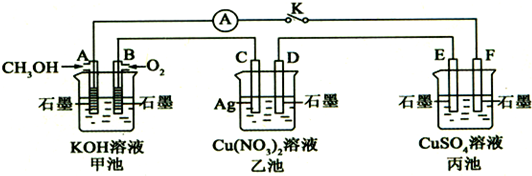
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com