
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJ
CH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
下列对有机物结构或性质的描述,错误的是
A.一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应
B.苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱
C.乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O
D.光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法 正确的是( )
正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO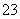 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是( )。

A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
A、H2O(g)==H2(g)+1/2O2( g) △H =—485KJ/mol
g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____ _____________________
_____________________ ______;
______;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)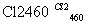 SiCl4
SiCl4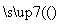 SiCl4(纯)
SiCl4(纯)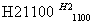 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程 式:________________________________________________________________________。
式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com