
| A. | 液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
分析 在水溶液中或熔化状态下能导电的化合物为电解质,在水溶液中和熔化状态下都不能导电的化合物为非电解质,以此来解答.
解答 解:A、液态HCl溶于水能导电,固态AgCl溶熔化状态下能导电,又属于化合物,所以液态HCl、固态AgCl是电解质,故A错误;
B、NH3和CO2本身不能电离出离子,溶于水反应生成一水合氨或碳酸电解质溶液导电,属于非电解质,故B错误;
C、蔗糖和酒精在水溶液里以分子存在,所以其水溶液不导电,蔗糖和酒精均是非电解质,故C正确;
D、铜和石墨均是单质,既不是电解质也不是非电解质,故D错误;
故选C.
点评 本题考查电解质与非电解质,注意二者均为化合物,特别注意电解质发生电离的为其本身,选项B为学生解答的易错点,难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
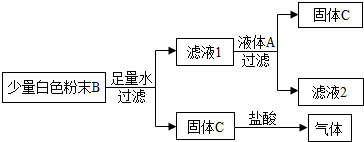
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+=2Fe2++4H++SO42- | |
| C. | 用白醋除铁锈:Fe2O3•xH2O+6H+=(3+x)H2O+2Fe3+ | |
| D. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2互为同位素 | |
| B. | 等质量的${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2所含有的分子数相同 | |
| C. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| D. | 通过化学变化可以实现${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2间的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
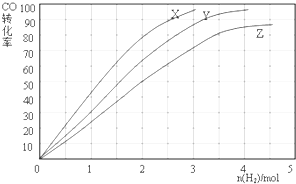
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子能够发生布朗运动 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子直径在1-100nm之间 | D. | 胶体粒子不能穿过半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
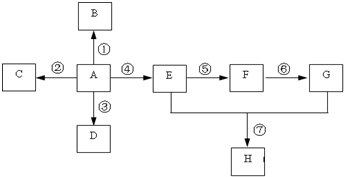 已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.
已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.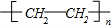 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com