
����Ŀ���������Һ��������Խǿ���絼��Խ��������0.1000 mol/L����ֱ�ζ�10.00 mLŨ�Ⱦ�Ϊ0.1000 mol/L��NaOH��Һ�Ͷ��װ�[(CH3)2NH]��Һ(���װ���ˮ�е����백���ƣ���֪�ڳ�����Kb[(CH3)2NH��H2O]=1.6��10-4)�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����( )
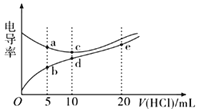
A.����ζ����װ�ʵ����ѡ���̪��ָʾ����ѡ��������С
B.d����Һ�У�c(H+)<c(OH-)+c[(CH3)2NH2+]
C.a����Һ��d�����Һ��Ϻ����Һ�У�c[(CH3)2NH2+]<c[(CH3)2NH��H2O]
D.b��c��e�������Һ�У�ˮ�ĵ���̶�������e��
���𰸡�B
��������
(CH3)2NHH2OΪ������ʣ�����Һ�в��ֵ��룬��Ũ��ʱ����Ũ�ȱ�NaOHС�����Խ������ɴ˿�֪��������Ϊ(CH3)2NHH2O�ı仯���ߣ�����ΪNaOH�ı仯���ߣ�����HCl��(CH3)2NHH2O��Һ������Ũ����������������ǿ��NaOH�����ᷢ���кͷ�Ӧ����ˮ������Ũ�ȼ�С����ͼ���֪����HCl 10 mLʱ��ȫ��Ӧ���Դ˽����⡣
A.����ζ����װ������ɵ�������װ�Ϊǿ�������Σ��ζ��յ���ҺӦ�����ԣ�Ӧ�ü���Ϊָʾ����A����
B��d��ǡ�÷�Ӧ����������װ���ˮ��������ԣ�����ˮ��̶Ƚ�С����c(H+)< c[(CH3)2NH2+]����c(H+)<c(OH-)+c[(CH3)2NH2+]������d����Һ�У����������غ㣬����c(H+)=c(OH-)+c[(CH3)2NH��H2O]������ˮ��̶Ƚ�С����c[(CH3)2NH2+]> c[(CH3)2NH��H2O]����c(H+)<c(OH-)+c[(CH3)2NH2+]��B��ȷ��
C��a����Һ�У�����Ϊ������NaCl��NaOH��d����Һ�У�����ΪCH3)2NH2Cl����a����Һ��d�����Һ��Ϻ�c[(CH3)2NH2+]=c[(CH3)2NH��H2O]����Һ����(CH3)2NH��H2O�ĵ����Լ�(CH3)2NH2+��ˮ�⣬��Kb[(CH3)2NH��H2O]=1.6��10-4��CH3)2NH2+��ˮ��ƽ�ⳣ��Kh=![]() =6.25��10-11<1.6��10-4����֪����̶ȴ���ˮ��̶ȣ����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C����
=6.25��10-11<1.6��10-4����֪����̶ȴ���ˮ��̶ȣ����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C����
D��b����Һ������Ϊ(CH3)2NH2Cl��(CH3)2NH��H2O��(CH3)2NH��H2O�����OH-����ˮ�ĵ��룬c������ΪNaCl��ˮ�ĵ�����Ӱ�죬e�����Һ������Ϊ(CH3)2NH2Cl��HCl��HCl����ˮ�ĵ��룬����c��ˮ�ĵ���̶����D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.Na2CO3 ��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH �� Kw ����С
B.0.1mol/L CH3COONa ��Һ�У�c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.�� KI ��Һ�м��� AgCl ���壬��Һ�� c(I-)��С
D.�����£�pH=5 �� CH3COOH ��Һ�� pH=5 �� NH4Cl ��Һ�У���Һ�� c(H+)�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol/L��NaOH��Һ�ֱ�ζ������Ϊ50.00 mL��Ũ�Ⱦ�Ϊ0.05 mol/L��HClO��HF������Һ����ζ�������ͼ��ʾ��
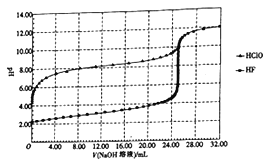
����˵����ȷ����
A.HClO�����Ա�HFǿ
B.V(NaOH)=0mLʱ����Ӧ��Һ�У�c(ClO-)=c(F-)
C.V(NaOH)=12.50mLʱ����Ӧ��Һ�У�c(ClO-)>c(F-)
D.V(NaOH)=25.00mLʱ����Ӧ��Һ�У�c(ClO-)<c(F-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽ״�ȼ�ϵ�صĽṹʾ��ͼ���״��ڴ����������ṩ���ӣ�H+���͵��ӣ����Ӿ����·�����Ӿ��ڵ�·������һ����������Ӧ������ܷ�ӦΪ2CH3OH +3O2![]() 2CO2+ 4H2O������˵������ȷ����
2CO2+ 4H2O������˵������ȷ����
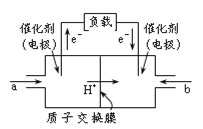
A.��缫Ϊ��صĸ�����a��ͨ��������Ǽ״�
B.������ӦʽΪ��O2+ 2H2O + 4e��= 4OH��
C.������ӦʽΪ��CH3OH + H2O-6e�� = CO2+ 6H+
D.�õ���ṩ1mole������������0.25mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����и��黯�����У���ѧ�����ͺͻ��������;���ͬ����_________������ţ���
A.CaCl2�� Na2S B.Na2O �� Na2O2
C.CO2��CaO D.HC1 �� NaOH
��2����֪1 molʯīת��Ϊ1 mol���ʯҪ������������1 molʯī��������1 mol���ʯ������____����ߡ��͡�����ʯī�Ƚ��ʯ_______����ȶ������ȶ�������
��3��Ba��OH��2 8H2O��NH4Cl��Ӧ�Ļ�ѧ����ʽ��____________���÷�Ӧ��___������ȡ����ȡ�����Ӧ����Ӧ���������仯��ͼ�����_____________���ͼ1����ͼ2������
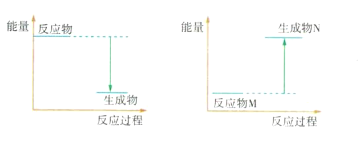
ͼ1 ͼ2
��4����ͼ3��ʾ�����Թܷ���ʢ�б��ͳ���ʯ��ˮ���¶�Ϊ25�棩���ձ��У������Թ��з��뼸С��þƬ�����õιܵ���5mL���ᡣ���Թ۲쵽�ձ��е�ʯ��ˮ���ɳ������ǣ��������������ԭ����___________________________��
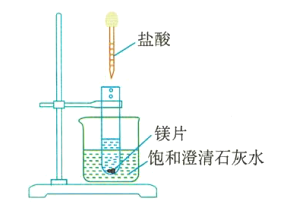
ͼ3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ��ʵ��װ������ⱥ��ʳ��ˮ,�������������������������Լ6 mL���ͼ��������������ԣ���Ӧ�������������������У���
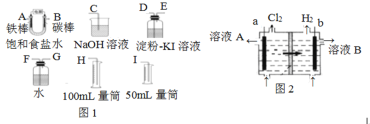
��1���Դ���ͼͼ1��ѡ�ü��ֱ�Ҫ������,����һ����װ��,���������ӿڵ�����˳�����ţ���:A��______,B��______��
��2��̼���Ϸ����ĵ缫��ӦΪ_______��
��3����˵���������������Ե�ʵ��������_______��
��4���ٶ�װ��ı���ʳ��ˮΪ50 mL�����ǰ����Һ����仯�ɺ��ԣ�,����õ�����Ϊ5.6 mL��������ɱ�״����ʱ,��Һ��pHΪ____��
��5����ҵ�ϲ������ӽ���Ĥ����ⱥ��ʳ��ˮ������ͼͼ2�������ӽ���Ĥ��__��������������������������������Ĥ����ҺA��_______�������ʵĻ�ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2SO2(g)��O2(g)![]() 2SO3(g) ��H<0�ķ�Ӧ������װ��ʾ��ͼ�е�ʵ�鲻�ܴﵽĿ���ǣ� ��
2SO3(g) ��H<0�ķ�Ӧ������װ��ʾ��ͼ�е�ʵ�鲻�ܴﵽĿ���ǣ� ��
A. �о�ѹǿ�Է�Ӧ��Ӱ��(p2>p1)
�о�ѹǿ�Է�Ӧ��Ӱ��(p2>p1)
B. �о��¶ȶԷ�Ӧ��Ӱ��
�о��¶ȶԷ�Ӧ��Ӱ��
C. �о�ƽ����ϵ������O2Ũ�ȶԷ�Ӧ��Ӱ��
�о�ƽ����ϵ������O2Ũ�ȶԷ�Ӧ��Ӱ��
D. ����㶨���ܱ������д����Է�Ӧ��Ӱ��
����㶨���ܱ������д����Է�Ӧ��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ��6sʱ��Ӧ�Ѵﵽƽ��״̬�����Ը÷�Ӧ���ƶ���ȷ���ǣ� ��

A���÷�Ӧ�Ļ�ѧ����ʽΪ3B+4D6A+2C
B����Ӧ���е�1sʱ��v��A��=v��C��
C����Ӧ���е�6sʱ��B��D�����ʵ���Ũ�Ⱦ�Ϊ0.4molL��1
D����Ӧ���е�6sʱ��B��ƽ����Ӧ����Ϊ0.05mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A�Ľṹ��ʽΪ![]() ����ش��������⣮
����ش��������⣮
��1��A�����������ŵ�������_______��______��
��2��A���ܷ����ķ�Ӧ��______������ţ���
��ȡ����Ӧ ����ȥ��Ӧ ��ˮ�ⷴӦ ��������Ӧ
��3����A���������Ƶ��Ҵ���Һ��ϲ����ȣ����õõ�����Ҫ������Ӿ۷�Ӧ��������ij�ۺ���þۺ���Ľṹ��ʽ��_____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com