
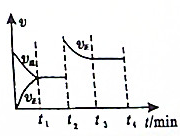
| A. | t2可能是升高温度 | |
| B. | t1时刻Y的体积分数可能比t3时刻Y的体积分数小 | |
| C. | t1时刻X的浓度可能比t3时刻X的浓度大 | |
| D. | t1时的平衡是从逆反应方向建立 |
分析 由方程式2X(g)+Y(g)?2Z(g)△H<0可知,该反应为放热反应,则升高温度,平衡逆向移动,由图象可知0~t1时刻逆反应大于正反应速率,则平衡逆向移动,t2时正反应速率突然增大,但达到平衡速率逐渐减小,则说明平衡正向移动,可加入X或Y,使反应物浓度增大,也可增大压强,以此解答该题.
解答 解:A.该反应为放热反应,则升高温度,平衡逆向移动,正反应速率应逐渐增大,逆反应速率逐渐减小,与图象不符,故A错误;
B.如加入Y,则平衡正向移动,正反应速率增大,达到平衡时Y的体积分数比原平衡大,故B正确;
C.如加入Y,平衡正向移动,则X的浓度逐渐减小,故C正确;
D.由图象可知0~t1时刻逆反应大于正反应速率,则平衡是从逆反应方向建立,故D正确.
故选A.
点评 本题考查化学平衡的建立,为高频考点,侧重学生的分析能力的考查,注意把握图象曲线变化的意义,把握影响平衡移动的因素,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | BaSO4溶解的量减小 | B. | BaSO4的电离程度减小 | ||
| C. | 溶液的导电能力增大 | D. | c (Ba2+)与c (SO42-)的乘积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生了砖红色沉淀,因黑色物质的遮盖而看不见 | |
| B. | 不可能产生砖红色沉淀,因为在加入少量新制备的Cu(OH)2前,没有把水解后的溶液调至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入的稀硫酸太少 | |
| B. | 不可能产生砖红色沉淀,因为水浴加热后未用碱液调节溶液的PH至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Cl2═2KCl+I2 | B. | CaCO3═CaO+CO2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | MgCl2+2NaOH═Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提出了原子学说 | B. | 发现了元素周期律 | ||
| C. | 提出了分子学说 | D. | 制定了科学完整的元素周期表 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com