
【题目】A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属” ,其基态原子外围电子占据两个能级且各能级电子数相等。请回答下列问题:
(1)A、B、C三种元素的第一电离能由小到大的顺序是_______(填元素符号)。
(2)D元素基态原子的核外电子排布式为____________________。
(3)白色晶体C3AB4中阴离子的空间立体构型是_______,中心原子的杂化方式是_____
(4)中学化学常见微粒中与A2B互为等电子体的分子有__________(任写一种即可)。
(5)已知D3+可形成配位数为6的配合物。现有组成皆为DCl3·6H2O的两种晶体,一种为绿色,另一种为紫色。为测定两种晶体的结构,分别取等量样品进行如下实验:
①将晶体配成水溶液,
②滴加足量AgNO3溶液,
③过滤出AgCl沉淀并进行洗涤、干燥、称量;
经实验测得产生的沉淀质量:绿色晶体是紫色晶体的2/3。依据测定结果可知绿色晶体的化学式为_______________,该晶体中含有的化学键有__________
a.离子键 b.极性键 c.非极性键 d.配位键
【答案】(1)Na<O<N(1分) (2)[Ar]3d24s2(1分) (3)正四面体(1分) sp3(1分)
(4)CO2或CS2(5)[Ti(H2O)5Cl]Cl2·H2O; abd
【解析】试题分析:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,则C为Na元素;D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等,则D为Ti元素,
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的核外电子排布式是[Ar]3d24s2;
(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+![]() =4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化;
=4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化;
(4)原子总数与价电子总数相同的微粒即为等电子体,利用代换法,可知与N2O互为等电子体的分子有CO2或CS2等;
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2H2O,含有离子键、极性键、配位键。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
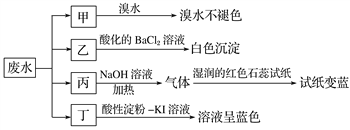
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9 g,继续通入足量的澄清石灰水中,得到沉淀50 g。求:
(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式(任写两种)
、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】[化学——选修3:物质结构与性质]NO2+和NO2都是常见的配位体,易与金属结合生成配合物。
(1)基态氧原子核外未成对电子数有__________个,基态氮原子的核外电子轨道示意图为__________。
(2)NO2+和NO2-中氮原子的杂化轨道类型分别为__________。
(3)为消除雾霾利用金属氧化物吸收氮的氧化物,MgO、BaO、CaO、SrO吸收氮的氧化物能力由强到弱的顺序为____________。
(4)下表为含氧酸根XO4n-的键长数据:
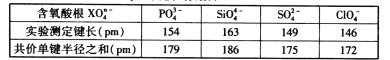
PO43-的空间构型为________。X-O之间的实测键长与理论键长有差异,其原因可能为X-O之间形成了多重键:首先是X原子的________轨道与O原子的2p轨道形成________键;其次是X原子的__________轨道与O原子的2p轨道形成________键。
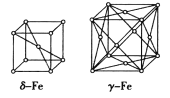
(5)铁有δ、γ两种晶体,如右图所示。两种晶体中距离最近的铁原子间距相同。δ -Fe中铁原子的配位数为__________,δ-Fe和γ-Fe的密度之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
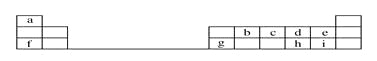
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下图所示:

(1)请列举海水淡化的一种方法____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________。
(3)步骤Ⅰ中已经获得Br2,步骤Ⅱ中又将获得的Br2还原为Br-,其目的是____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为_____________________________________。由此反应可知,除保护环境外,在工业生产中还应解决的问题是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答:
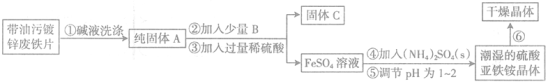
(1)步骤①中碱液洗涤的目的是 。若将碱液换为酸液,可能产生的问题是_ 。
(2)步骤②中B可以是 (填字母),加入少量B的目的是 。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)步骤⑥中要用到少量乙醇洗涤,其目的是 。
(4)用硫酸亚铁按晶体配制溶液时,需加入一定量硫酸,目的是 。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为 。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于 (填“酸式”或“碱式”)滴定管中。
(5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是 ,实验室的检验方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com