
配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500 g 成分表:氯化钠≥88% 钙(以Ca计)(0.5~13.)% 碘(以I计)(20~50)mg·kg-1 |
(1)包装标签上钙含量是指_______(填“单质钙”“碳酸钙”或“钙元素”中的一种)。
(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是_______。
(3)为了测定此盐中的钙元素含量,取10 g这种盐溶于水,加入足量盐酸,生成0.132 g二氧化碳。请计算此加钙食盐中钙元素的质量分数_______。
科目:高中化学 来源: 题型:阅读理解

(1)包装标签上钙含量是指______________(填“单质钙”“碳酸钙”或“钙元素”中的一种)。
(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是______________。
(3)为了测定此盐中的钙元素含量,取
查看答案和解析>>
科目:高中化学 来源: 题型:

沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有________________________(要求写出两条)。
(2)滤渣Ⅰ的主要成分有____________________________。
(3)从滤液Ⅱ中可回收利用的主要物质有________________________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3====Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
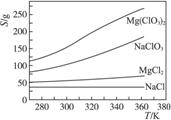
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:________________________________________________________________________。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______________________________。除去产品中该杂质的方法是:_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市和平区高三第一次质量调查理综化学试卷(解析版) 题型:实验题
(1)某厂利用生产磷铵排放的磷石膏废渣制硫酸联产水泥,硫酸返回用于生产磷铵。其生产流程图如下:
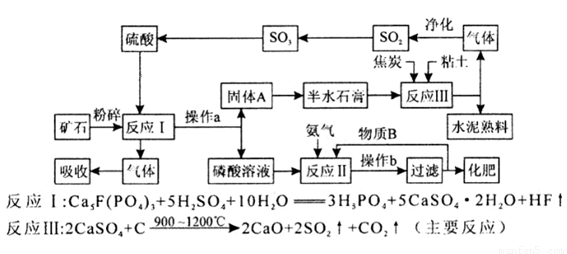
①操作b的名称是浓缩、冷却、 。
②如反应II的产物是两种酸式盐,则物质B中溶质的化学式是 。
③若在实验室中对反应II产生的气体用 吸收。
④该生产流程最大的优点是尽可能地实现原料的循环使用和副产物的综合利用,该生产流程体现的基本思想是 。
(2)为测定同体磷铵化肥中铵态氮的质量分数,实验室用下图所示装置进行实验。实验时,在A中加入mg磷铵样品,关闭止水夹a.打开止水夹b,向A中加入足量的浓NaOH溶液,完全反应后C中浓硫酸增重ng。请回答下列问题:
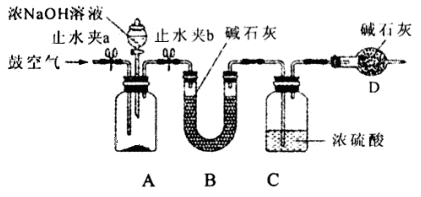
①试说明检查该装置气密性的操作方法和实验现象 。
②装置B的作用是 ,装置D的作用是 。
③实验过程应该在何时鼓入空气?答: (填“开始前”、“过程中”或“反应后”)
④如某次测定的铵态氮的质量分数明显偏低,则可能的原因是 (填字母)。
A.磷铵样品与氢氧化钠未充分反应 B.A和B中残留了一定量的氨气
C.氢氧化钠溶液的浓度太大 D.鼓气过快
⑤固体磷铵化肥中铵态氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:实验题
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2  2Fe2O3
+ 8SO2
2Fe2O3
+ 8SO2

II反应结束后,将乙瓶中的溶液进行如下处理

(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com