
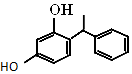
 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 分子式为C14H14O2 | |
| C. | 1 mol该物质与溴水反应时最多能消耗2 mol的Br2 | |
| D. | 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊 |
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Ca(OH)2 | C. | SiO2 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
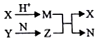 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N<M | B. | .简单离子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | .图中有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
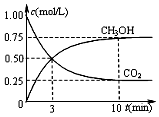 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.
某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
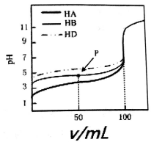
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com