
| ||
| x |
| 2 |
| ||
| 3 |
| 2 |
| x |
| 2 |
| 3 |
| 2 |
| x |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、正、逆反应速率都等于零 |
| B、N2、H2、NH3的浓度均不再变化 |
| C、N2、H2、NH3在容器中共存 |
| D、N2、H2、NH3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C6H12O6
| |||
B、HC≡CH+HCl
| |||
C、 | |||
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10-4 | 4.0×10-4 | 4.0×10-4 | υ(正)=υ(逆) |
| ② | 1.0×10-3 | 4.0×10-4 | 5.0×10-4 | υ(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为: 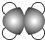 ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为 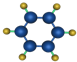 |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯E |
①由C、H、O三种元素组成; ②球棍模型为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com