
| A. | pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L | |
| B. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | pH=3的醋酸溶液加水稀释过程中:$\frac{c(O{H}^{-})}{c({H}^{+})}$逐渐增大 | |
| D. | 0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-) |
分析 A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.醋酸是弱电解质,常温下,pH=3的醋酸溶液浓度大于pH=11氢氧化钠溶液,二者等体积混合后溶液中醋酸有剩余,溶液呈酸性;
C.醋酸在稀释过程中促进电离,导致c(OH-)增大、c(H+)减小;
D.等物质的量浓度的 Na2CO3溶液和NaHSO4溶液等体积混合,二者恰好反应生成硫酸钠、碳酸氢钠,溶液电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以醋酸抑制水电离,氯化铵促进水电离,由水电离出的c(H+)前者为10-5 mol/L,后者为10-9 mol/L,故A错误;
B.醋酸是弱电解质,常温下,pH=3的醋酸溶液浓度大于pH=11氢氧化钠溶液,二者等体积混合后溶液中醋酸有剩余,溶液呈酸性,所以pH<7,故B错误;
C.醋酸在稀释过程中促进电离,导致c(OH-)增大、c(H+)减小,溶液体积相等,溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$逐渐增大,故C正确;
D.等物质的量浓度的 Na2CO3溶液和NaHSO4溶液等体积混合,二者恰好反应生成硫酸钠、碳酸氢钠,溶液电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),故D正确;
故选CD.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒来分析解答,易错选项是CD,注意C中粒子浓度变化特点,D中易漏掉硫酸根离子浓度.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
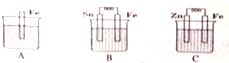
 |  | 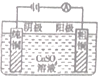 |  | |
| 化工 | 氯碱工业 | 高炉炼铁 | 铜的精炼 | 生产漂白粉 |
| 原理 | 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+ H2↑ | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 阴极: Cu2++2e-═Cu | 2NaOH+Cl2═NaCl+NaClO+H2O |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
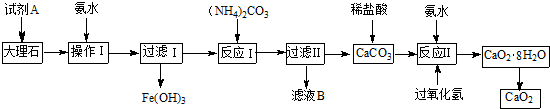
| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4)/mL | 19.50 | 21.50 | 19.48 | 19.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
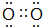 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
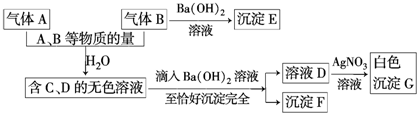
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定有分子碰撞 | B. | 化学反应的活化能一定大于零 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 发生有效碰撞的分子是活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根瘤菌把氮气转化为氨 | B. | 氮气和氢气在适宜条件下合成氨 | ||
| C. | 氮气和氧气在放电条件下合成NO | D. | 工业上用氨和二氧化碳合成尿素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com