
| A. | 铁 | B. | 硅 | C. | 碳 | D. | 铝 |
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
 ,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O
,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中三个碳原子在同一条直线上 | |
| B. | 丙烯可使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯可使溴水褪色 | |
| D. | 丙烯能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
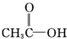 )和羟基乙醛(
)和羟基乙醛(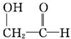 )互为同分异构体.
)互为同分异构体.| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水,且必须比水的密度大 | |
| B. | 难溶于水,且比水溶解溴的能力强 | |
| C. | 易溶于水,且比水溶解溴的能力弱 | |
| D. | 难溶于水,且必须与溴单质发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、OH-、Cl- | B. | H+、Mg2+、NO3-、SiO32- | ||
| C. | Fe3+、NH4+、SCN-、F- | D. | Na+、Cu2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  | 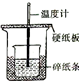 |
| A.测量锌与稀硫酸反应的速率 | B.构造铜锌原电池 | C.进行酸碱中和滴定实验 | D.测定中和热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Y | U | |||
| X | V | W |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com