
| A. | 0.7 mol | B. | 0.9 mol | C. | 1.1 mol | D. | 1.3 mol |
分析 平衡体系中n(O)=2n(SO2)+3n(SO3)+2n(O2),n(S)=n(SO2)+n(SO3),原平衡时SO2、O2和SO3的物质的量之比为3:4:6,则平衡体系中n(S):n(O)=9:(6+8+18)=9:32.
解答 解:平衡体系中n(O)=2n(SO2)+3n(SO3)+2n(O2),n(S)=n(SO2)+n(SO3),原平衡时SO2、O2和SO3的物质的量之比为3:4:6,则平衡体系中n(S):n(O)=9:(6+8+18)=9:32,故[2mol+n(SO2)]:[2.2mol+6mol+2n(SO2)]=9:32,解得n(SO2)=0.7mol,
故选:A.
点评 本题考查化学平衡计算,侧重考查学生分析计算能力,注意利用原子守恒进行计算,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 | |
| B. | 世博会期间,利用可降解的“主米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆“东方之冠”使用的钢筋混凝土属于高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO 转化为无毒气体CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为:
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为: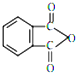 +2CH3CH2CH2CH2OH→
+2CH3CH2CH2CH2OH→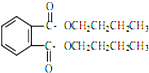 +H2O
+H2O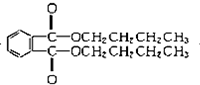 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$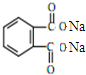 +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com