
【题目】某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为2mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是( )
A.该溶液中所含的离子是:Fe2+、Al3+、SO42-、NO3-
B.若向该溶液中加入过量的稀硫酸,产生的气体分子数为1/3NA
C.若向该溶液中加入过量的稀硫酸后若再滴加FeCl2溶液,没有现象
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为160g
【答案】D
【解析】
向该溶液中加入稀硫酸,有气泡产生,则一定发生Fe2+、NO3﹣的氧化还原反应生成硝酸铁和NO,阴离子种类不变,则原溶液中存在SO42﹣,又溶液中含有四种离子,所含离子的物质的量均为2mol,由电荷守恒可知,含有带一个单位正电荷的阳离子,即一定含有Na+;综上所述溶液中含有Fe2+、Na+、SO42-、NO3-。
A.由上述推断可知,该溶液中所含的离子是:Fe2+、Na+、SO42﹣、NO3﹣,不含Al3+,故A错误;
B.若向该溶液中加入过量的稀硫酸,发生反应3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,2mol Fe2+完全反应产生的气体分子数为![]() NA,故B错误;
NA,故B错误;
C.含离子的物质的量均为2mol,加过量的硫酸,根据3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,硝酸根离子有剩余,若再滴加FeCl2溶液,继续发生3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,有气体放出,故C错误;
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为氧化铁,Fe2+的物质的量是2mol,生成氧化铁1mol,其质量为1mol×160g/mol=160g,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】完成下列有关物质的量的计算
(1)![]() 个
个![]() 分子的物质的量是________
分子的物质的量是________![]() 。
。
(2)标准状况下,![]() 的体积是_________L。
的体积是_________L。
(3)含有相同氧原子数的![]() 和
和![]() ,其分子的质量比为_________。
,其分子的质量比为_________。
(4)标准状况下,![]() 气体溶于水配制成
气体溶于水配制成![]() 溶液,其物质的量浓度为_______
溶液,其物质的量浓度为_______![]() 。
。
(5)![]() 碳在一定量的氧气中完全燃烧,反应后生成
碳在一定量的氧气中完全燃烧,反应后生成![]() 和
和![]() 混合气体的平均摩尔质量是
混合气体的平均摩尔质量是![]() ,则生成的
,则生成的![]() 的质量是_____
的质量是_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙,下列有关物质的推断不正确的是( )
丙,下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是氯气
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是
A. 甲、乙、丙三种物质都含有氮元素 B. 反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C. Ⅵ的产物可在上述流程中被再次利用 D. 丁为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.蛋白质是仅由碳、氢、氧、氮元素组成的一类高分子化合物
B.一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
C.![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
D.用甲苯分别制取TNT、邻溴甲苯和苯甲酸所涉及的反应均为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:____________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下2.24L O2时,转移电子为______ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在其水溶液中的电离方程式:______。(只写第一步)
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确:___________
Ⅱ.工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
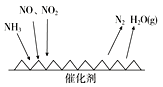
(1)由上图可知SCR技术中的氧化剂为________。
(2)用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________________________________
Ⅲ.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4 kJ/mol
2CH3OH(g) △H2= +23.4 kJ/mol
反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
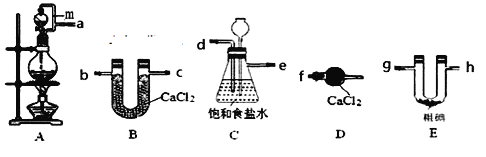
(1)装置A中发生反应的化学方程式为_________________________。
(2)按照气流方向连接接口顺序为a→_________________。装置A中导管m的作用是________。
(3)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为____________________。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为________。装置E中发生反应的化学方程式为__________________。
(5)该装置存在的明显缺陷是_________。
(6)粗碘的制备流程为:
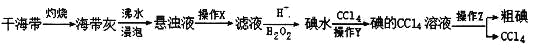
操作Y用到的玻璃仪器有烧杯、____________,操作Z的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
MnCl2+Cl2↑+2H2O②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A.15∶5∶3B.1∶3∶5C.6∶5∶6D.1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量 FeS2)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如图,下列叙述错误的是( )
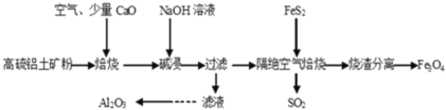
A.烧渣分离可以选择用磁铁将烧渣中的 Fe3O4 分离出来
B.隔绝空气焙烧时理论上反应消耗的 n(FeS2)∶n(Fe2O3)=1∶6
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得 Al2O3
D.加入 CaO 可以减少 SO2 的排放同时生成建筑材料 CaSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com