
|
25 ℃时,NH3·H2O在水中的电离达到平衡:NH3·H2O | |
| [ ] | |
A. |
向稀氨水中继续加入水,平衡正向移动, c(OH-)增大 |
B. |
向稀氨水中继续缓慢加入水, |
C. |
向稀氨水中加入少量固体 CH3COONH4,平衡逆向移动,c(H+)减小 |
D. |
将稀氨水加热 ,KW增大,pH变大 |
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
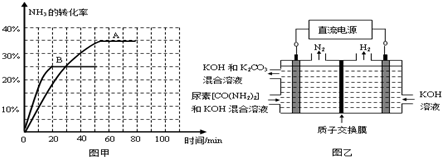
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二第二次月考化学试卷(解析版) 题型:填空题
已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的__________(填写编号),然后测定溶液的pH。
A.、固体CH3COOK B、固体CH3COONH4
C、气体NH3 D、固体NaHCO3
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”减小”或“不变”)。(已知:25 ℃时,NH3·H2O的Ka=1.8×10-5,CH3COOH的Kb=1.8×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com