
| A. | 有机物在滤液中 | B. | 杂质在滤液中 | C. | 有机物滤纸上 | D. | 杂质在溶剂中 |
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
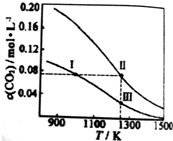
| A. | 反应CO2(g)+c(s)?2CO(g)△H<0 | |
| B. | 反应速率:V逆(状态Ⅰ)>V逆(状态Ⅲ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 体系的压强:2P总(状态Ⅰ)>P总(状态Ⅱ)>P总(状态Ⅰ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②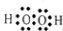 ③
③ ④
④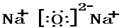 ⑤
⑤ ⑥
⑥ ⑦
⑦
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
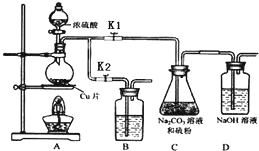 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比1:1 | B. | 体积比11:16 | C. | 分子个数比1:1 | D. | 密度比11:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com