
下列有关气体摩尔体积的描述中正确的是 ( )
A.气体摩尔体积为22.4 L·mol-1
B.1 mol O2的质量是32 g,它所占的体积是22.4 L
C.标准状况下,1 mol任何物质的体积均约为22.4 L
D.标准状况下,6.02×1023个CO分子的体积约为22.4 L
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年山东省高二第二次月考化学试卷(解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
该反应在低温下________(填“能”或“不能”)自发进行。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)
TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(3)已知在400 ℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g) N2(g)+3H2(g)的K′=___________(填数值)。
N2(g)+3H2(g)的K′=___________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正___________(填“>”“<”“=”或“不确定”)v(N2)逆。
(4) 离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl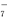 和AlCl
和AlCl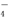 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上月考一化学卷(解析版) 题型:选择题
| 物质 | 杂质 | 除杂所用试剂和方法 |
A | KCl溶液 | I2 | 酒精,萃取,分液 |
B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
C | Cu | CuO | 盐酸,过滤 |
D | CaCO3 | CaO | H2O,过滤 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高一上第一次月考化学试卷(解析版) 题型:选择题
科学家刚刚发现了某种元素的原子,其一个原子的质量是a g,12C的一个原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A.该原子的摩尔质量是aNA
B.W克该原子的物质的量一定是W/(aNA) mol
C.W克该原子中含有W/b 个该原子
D.由已知信息可得 : NA = 12/a
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高一上第一次月考化学试卷(解析版) 题型:选择题
配制100 mL 1 mol·L-1氢氧化钠溶液,下列操作错误的是( )
A. 在托盘天平上放两片大小、质量相同的纸,然后将氢氧化钠放在纸片上进行称量
B. 把称好的NaOH放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C. 用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
D. 沿着玻璃棒往容量瓶中加入蒸馏水,到离刻度线2~3 cm时改用胶头滴管滴加,直到溶液凹液面恰好与刻度线相切
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高一上第一次月考化学试卷(解析版) 题型:选择题
通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠 B.氧化铜、二氧化锰
C.氯化钾、二氧化锰 D.硫酸铜、氢氧化钡
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(解析版) 题型:填空题
(1)已知2mol H2完全燃烧生成液态水放出572 kJ热量。写出H2燃烧热的热化学反应方程式:_____________________。
(2)在25 ℃、101 kPa下,1 g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出该反应的热化学方程式 _______________________ 。
(3)已知热化学方程式:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH1=—2602.0kJ•mol-1
②C(s)+O2(g)=CO2(g) △H2=—393.5kJ•mol-1
③H2(g)+ O2(g)=H2O(l) △H3=—285.8kJ·mol-1
O2(g)=H2O(l) △H3=—285.8kJ·mol-1
则反应④2C(s)+H2(g)=C2H2(g)的△H为 ____________ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次月考化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元 素 | Mn | Fe | |
电离能 | I1 | 717[ | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1) Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
(2) Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
(3) 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 ;
(4) 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com