

| 0.02mol×72g/mol |
| 2.0g |


科目:高中化学 来源:不详 题型:单选题
| A.可能有CO2 | B.可能有O2和CO2 |
| C.肯定有SO2和NO | D.肯定没有Cl2、O2和NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用分液漏斗分离乙酸和乙酸乙酯 |
| B.用品红溶液鉴别SO2和CO2两种气体 |
| C.用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
| D.用盛有NaOH溶液的洗气瓶除去CO2中混有的HCl气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
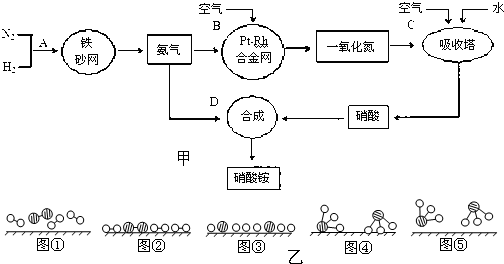
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
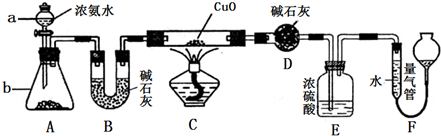
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含______离子 |
| ②______ | 确定M溶液中含有Na+,不含K+ |
③用pH试纸检测M溶液,pH试纸呈蓝色 | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
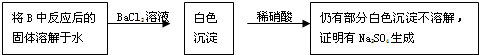
| SO | 2-4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 物质 | (CH3CO)2O | C6H5CHO | C6H5CH=CHCOOH | CH3COOH |
| 沸点 | 139℃ | 179℃ | 300℃ | 117.9℃ |
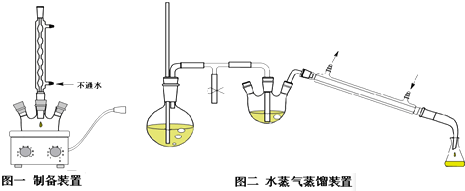
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
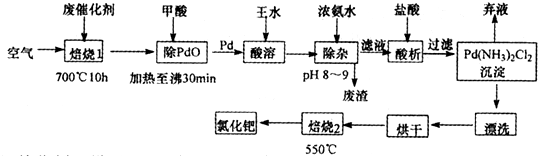
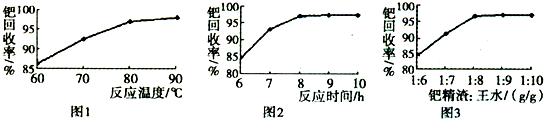
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com