



科目:高中化学 来源: 题型:
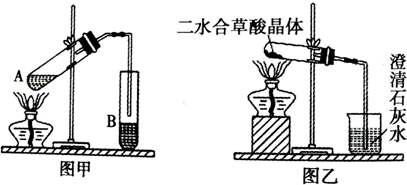
| 175℃ |
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
查看答案和解析>>
科目:高中化学 来源: 题型:
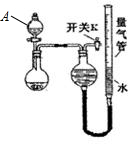
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
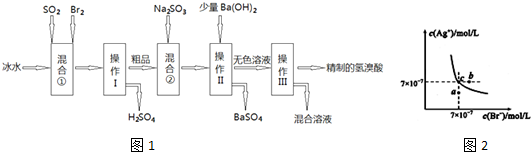
查看答案和解析>>
科目:高中化学 来源: 题型:
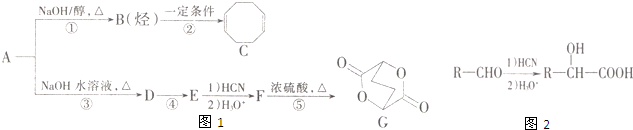
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易形成一价离子 |
| B、从上到下单质的氧化性逐渐减弱 |
| C、从上到下氢化物的沸点逐渐升高 |
| D、从上到下氢化物的稳定逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com