
| A、用广泛pH试纸测得某溶液的pH为2.3 |
| B、酸碱中和滴定实验中,锥形瓶必须用待测液润洗 |
| C、用已知浓度的盐酸滴定未知浓度的NaOH溶液时,若读取标准液读数时,滴前仰视,滴定到终点后俯视,会导致测定结果偏低 |
| D、用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL |
| C(标准)×V(标准) |
| V(待测) |
| c(酸)V(酸) |
| V(碱) |
| C(标准)×V(标准) |
| V(待测) |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、石英(SiO2)是制造玻璃的重要原料之一 |
| B、石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、晶体硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加入NaOH 溶液:HCO3-+OH-═CO2↑+H2O |
| B、在NaOH溶液中滴入少量AlCl3溶液:Al3++3OH-═Al(OH)3↓ |
| C、甲酸溶液中滴入NaOH溶液:HCOOH+OH-═HCOO-+H2O |
| D、CO2通入CaCl2溶液:CO2+H2O+Ca2+═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、R的氧化物及其对应的水化物均具有两性 |
| B、L、M的单质均用电解其熔融盐的方法冶炼 |
| C、T的氢化物还原性及稳定性均比Q的氢化物强 |
| D、五种元素的常见简单离子中半径最大的是Q2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将含有HCl杂质的CO2通入饱和Na2CO3溶液中 | 除去CO2中的HCl |
| B | 向含氯化铁杂质的氯化铵溶液中加入氢氧化钠溶液,过滤 | 除去氯化铵中的氯化铁 |
| C | 向碘水中加入四氯化碳 | 萃取碘水中的碘 |
| D | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
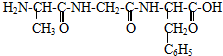
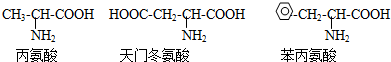
| A、D-12 | ||
| B、D-13 | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
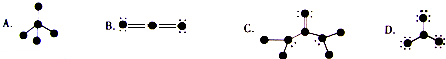
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com