
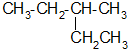 的系统命名为
的系统命名为 和一个-F,符合此要求的可能结构有
和一个-F,符合此要求的可能结构有| 102 |
| 12 |
| 2×8+2-6 |
| 2 |
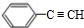 ,
, ;
;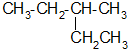 的主链有5个碳原子,甲基在在3号碳上,所以名称为3-甲基戊烷;
的主链有5个碳原子,甲基在在3号碳上,所以名称为3-甲基戊烷; ;
; ;
;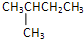 、
、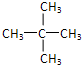 .
.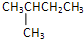 ,一元取代产物有:CH3CH(CH3)CH2CH2F;CH3CH(CH3)CHFCH3;CH3CF(CH3)CH2CH3;CH2FCH(CH3)CH2CH3,其中CH3CH(CH3)CH2CH2F;CH2FCH(CH3)CH2CH3符合条件.
,一元取代产物有:CH3CH(CH3)CH2CH2F;CH3CH(CH3)CHFCH3;CH3CF(CH3)CH2CH3;CH2FCH(CH3)CH2CH3,其中CH3CH(CH3)CH2CH2F;CH2FCH(CH3)CH2CH3符合条件. ,一元取代产物有:CH3C(CH3)2CH2F,不符合条件.
,一元取代产物有:CH3C(CH3)2CH2F,不符合条件. ;Al4C3与水反应生成氢氧化铝和甲烷,而生成氢氧化铝能与NaOH反应生成偏铝酸钠和水,所以Al4C3溶于NaOH的化学反应方程式Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑;
;Al4C3与水反应生成氢氧化铝和甲烷,而生成氢氧化铝能与NaOH反应生成偏铝酸钠和水,所以Al4C3溶于NaOH的化学反应方程式Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑; ;Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑;
;Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑;


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答:
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al、Fe、Cu在潮湿空气中放置一段时间后均只生成氧化物 |
| B、金属Mg与稀硫酸和CO2均能反应,其反应类型相同 |
| C、浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同 |
| D、氯气具有很强的氧化性,在化学反应中只能做氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com