
|
在298 K 1.01×l05 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应.测得反应放出x kJ的热量.已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量.则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是 | |
| [ ] | |
A. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(4x-y)kJ/mol |
B. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(2x-y)kJ/mol |
C. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(2y-x)kJ/mol |
D. |
2SO2(g)+2KOH(1)=2KHSO3(1) ΔH=-(8x-2y)kJ/mol |
科目:高中化学 来源:四川省金堂中学2011-2012学年高二下学期期中考试化学试题 题型:058
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为________.(填序号)
a、0.20 mol·L-1
b、0.12 mol·L-1
c、0.10 mol·L-1
d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:________
(6)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1________K2(填“>”“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)化学反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在298 K、100 kPa下:ΔH=-113.0 kJ·mol-1 ΔS=-145.3 J·mol-1·K-1,反应在常温下_______(填“能”或“不能”)自发进行。?
N2(g)+2CO2(g),在298 K、100 kPa下:ΔH=-113.0 kJ·mol-1 ΔS=-145.3 J·mol-1·K-1,反应在常温下_______(填“能”或“不能”)自发进行。?
(3)求反应2HCl(g)![]() H2(g)+Cl2(g)的标准熵变。已知:HCl(g)的S=186.6 J·K-1·mol-1,H2(g)的S=130 J·K-1·mol-1,Cl2(g)的S=223 J·K-1·mol-1,ΔS=______________。?
H2(g)+Cl2(g)的标准熵变。已知:HCl(g)的S=186.6 J·K-1·mol-1,H2(g)的S=130 J·K-1·mol-1,Cl2(g)的S=223 J·K-1·mol-1,ΔS=______________。?
查看答案和解析>>
科目:高中化学 来源: 题型:
(2011·威海毕业考试)在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/(mol·L-1·s-1) | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
A.0.0380 mol·L-1·s-1 B.0.152mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
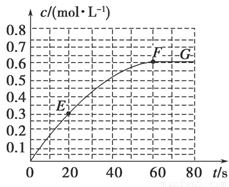
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《化学反应速率与化学平衡》专题综合测试(苏教版) 题型:选择题
(2011·威海毕业考试)在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
|
实验编号 |
1 |
2 |
3 |
4 |
5 |
|
c(HI)/(mol·L-1) |
0.100 |
0.200 |
0.300 |
0.100 |
0.100 |
|
c(H2O2)/(mol·L-1) |
0.100 |
0.100 |
0.100 |
0.200 |
0.300 |
|
v/(mol·L-1·s-1) |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
0.0228 |
A.0.0380 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com