
| A. | 聚氯乙烯一次性超薄袋可用于包装食品 | |
| B. | 利用电渗析法和离子交换法能获得纯净水 | |
| C. | 体积分数为95%的酒精用作医用酒精 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
分析 A.聚氯乙烯塑料中的增塑剂有毒;
B.水淡化是指除去海水中的盐分以淡水的工艺过程(又称海水脱盐),其方较多,如反渗透、水合物、电渗透、压渗等;
C.体积分数为75%的酒精用作医用酒精;
D.裂化的目的是得到轻质油.
解答 解:A.聚氯乙烯塑料中的增塑剂有毒,不能用于包装食品,故A错误;
B.水淡化是指除去海水中的盐分以淡水的工艺过程(又称海水脱盐),其方较多,如反渗透、水合物、电渗透、压渗等,电渗析法和离子交换法能获得纯净水,故B正确;
C.体积分数为75%的酒精用作医用酒精,故C错误;
D.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,故D错误.
故选B.
点评 本题考查较为综合,涉及盐类的水解、金属的腐蚀与防护、塑料的使用以及环境保护等知识,侧重于基础知识的考查,有利于培养学生的良好的科学素养,难度不大,注意相关基础知识的积累.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
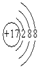

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C4H6 C3H8 | B. | C5H10 C6H6 | C. | C2H6O C2H4O2 | D. | C3H6 C3H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
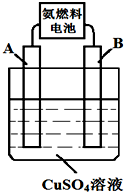 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com