
����Ŀ��������ԭ��Ӧ��Ӧ�ñȽϹ㷺���Ķ�����IJ��ϣ������ػ�ѧ֪ʶ�ش��������⡣�ڻ�ҩ��Ҫ������ء���ǡ�ľ̿���߷�ĩ�Ļ����ڵ�ȼ�����£��仯ѧ��Ӧʽ��ҪΪ��2KNO3+S+3C=N2��+3CO2��+K2S
��1���ںڻ�ҩȼ�յķ�Ӧ�У�������Ϊ___��
��2���÷�Ӧ��������Ԫ����___��
��3���÷�Ӧ������������___��
��4��KNO3��NԪ�صĻ��ϼ���___��
��5�����ݻ�ѧ��Ӧʽ������һ����ԭ�Ӳ��뷴Ӧʱת��___�����ӣ�
��6����Cl2ͨ��Ũ��ˮ�У��������·�Ӧ��3Cl2+8NH3=6NH4Cl+N2����˫���ű�ʾ��Ӧ�ĵ���ת�Ʒ������Ŀ��___��
��7����֪�������з�Ӧ����ClO3-��5Cl-��6H+ =3Cl2��3H2O ��2Fe2+��Cl2=2Fe3+��2 Cl-����ClO3-��Fe3+��Cl2����������������ǿ������˳����___��
���𰸡�KNO3��S C CO2 +5 2 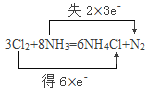 ClO3����Cl2��Fe3��
ClO3����Cl2��Fe3��
��������
��1��������ָ�ڷ�Ӧ����Ԫ�ػ��ϼ۽��͵����ʣ��ڷ�Ӧ��KNO3��NԪ����+5��Ϊ0�ۡ�S��0�۽�Ϊ-2�ۣ�������������KNO3��S��
��2����������Ԫ����ָ�ڷ�Ӧ�л��ϼ����ߵ�Ԫ�أ�C��0������Ϊ+4�ۣ���C��������
��3��C��0������Ϊ+4�ۣ���C���������÷�Ӧ������������CO2��
��4�����ݻ�������Ԫ�ص��������ϼ۴�����Ϊ0��KNO3��NԪ�صĻ��ϼ���+5��
��5����Ӧ��S��0�۽�Ϊ-2�ۣ��õ�2�����ӣ����ݻ�ѧ��Ӧʽ������һ����ԭ�Ӳ��뷴Ӧʱת��2�����ӣ�
��6����Ӧ3Cl2+8NH3=6NH4Cl+N2�У�ClԪ�ػ��ϼ���0��-1�ۣ�NԪ�ػ��ϼ���-3����0�ۣ�������ԭ��Ӧ�������뻹ԭ����ʧ������Ŀ��ȣ�����Ϊ���ϼ�����������ȣ���˫���ű������ת�Ƶķ������Ŀ��Ϊ�� ��
��
��7��ͬһ������ԭ��Ӧ�У��������������Դ�����������������ԣ���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ���Ӧ��ClO3-��5Cl-��6H+ =3Cl2��3H2O ��ClO3������������Cl2�������������������ClO3����Cl2����Ӧ��2Fe2+��Cl2=2Fe3+��2 Cl-��Cl2����������Fe3��������������������ԣ�Cl2��Fe3������ClO3-��Fe3+��Cl2����������������ǿ������˳����ClO3����Cl2��Fe3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ�������仯��˵����ȷ����

A. ��ͼ��ʾ�Ļ�ѧ��Ӧ�У���Ӧ��ļ���֮�ʹ���������ļ���֮��
B. ��ͬ�����£�������������Ӧ����Һ̬ˮ�����ɵ�������̬ˮ�ų���������
C. ���ʯ��һ��������ת����ʯī�����仯��ͼ��ʾ���ȷ�Ӧ����ʽ��Ϊ:C(s���ʯ) =C(s��ʯī) H��-(E2��E3)kJ��mol��1
D. ͬ��ͬѹ�£�H2(g)+C12(g)==2HCl(g)�����仯��ͼ��ʾ���ڹ��պ͵�ȼ�����µ���H��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�����Ħ������ΪM g��mol-1��������ĿΪN��������m g�������ӵ�����ΪNA��m��C��Ϊ12Cԭ����������˵�����и�ʽ����ʾ�����塣
��![]() ________________________________��
________________________________��
��![]() _______________________________��
_______________________________��
��![]() ___________________________________��
___________________________________��
��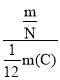 _____________________��
_____________________��
(2)����������ͬ�¶ȡ�ͬ�����ͬ����ʱ��ѹǿ��������_______________��
A.CO2 B.CO C.CH4 D.H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ1 mL 0.1 mol��L-1 AgNO3��Һ��������ʵ��(ʵ���������Լ�Ũ�Ⱦ�Ϊ0.1 mol��L-1)��

����˵������ȷ����
A. ʵ��ٰ�ɫ���������ܵ�AgCl B. ��ʵ���˵��AgI��AgCl������
C. �����٢�˳��ʵ�飬��������ɫ���� D. �����ڢ�˳��ʵ�飬��������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1��������Ϊ37����ԭ�ӷ���Ϊ_______��
��2��S2-�Ľṹʾ��ͼΪ______��
��3����ԭ�ӵĵ���ʽΪ______��N2�ĵ���ʽΪ______��NH4+�ĵ���ʽΪ_________
��4����ԭ�ӵĺ�������Ų�ʽΪ______����۵����Ų�ʽΪ_____����۵����Ų�ͼΪ_____��
��5�����а���p���������ԭ�ӵĺ�������Ų�ʽΪ_______��Ԫ������Ϊ_______��
��6������õķǽ���Ԫ��ԭ�ӵĺ�������Ų�ʽΪ_______��Ԫ������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
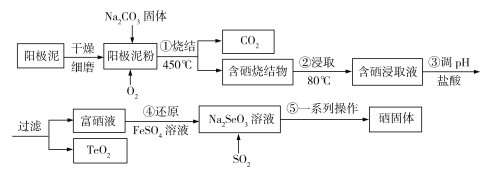
����Ŀ����14�֣���ҵ�ϳ����մ��սᷨ��ȡ��Ȼ���е�ϡɢԪ����(Se)���ҹ�������Ա������Ƶ����ô�ͭ��⾫����������������ͭ(Cu2Se)���ڻ���ͭ(Cu2Te)��������Ϊԭ�ϣ���ȡ����ij�ֹ���������ͼ��ʾ��
�ش��������⣺
��1����⾫��ͭʱ����Դ����������_______��������ͭ��������ͭ�����������ܽ�ͭ������__________������������=��������������������ͭ��������
��2�����ս���ʱ�մ��������ͭ��Ҫ������Na2SeO3��Cu2O��CO2���壬�÷�Ӧ�Ļ�ѧ����ʽΪ________________________________�����ս���ʱ�������ٲ���Na2SeO4��д������ԭ��ʱ��Ӧ�����ӷ���ʽ____________��
��3�������ս����ȡʱ����Ѽ��ȷ�ʽΪ________________����ȥ������Ϊ___________���ѧʽ����
��4�������ո�����TeO2����������������������������ϣ�������ǿ���ǿ����γɸ��Σ���TeO2����______�������������������������������������
��5�������Ṥҵ��һ���IJ���SO2ͨ��Na2SeO3��Һ�Ʊ������ʣ�д���÷�Ӧ�����ӷ���ʽ___________________�����õ�50 kg�����ʣ�������Ҫ___________kg��������Ϊ90%��FeS2��ʯ�����������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����Ϊ�ɼ��Ķ��Ѻ��¼����γɹ��̡���ѧ���ļ������γɻ�ѧ��ʱ�ͷŵ���������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P��198P��O��360O=O��498����ӦP4(����)��3O2=P4O6�ķ�Ӧ�Ȧ�HΪ ( )

A. ��1638 kJ��mol��1B. ��1638 kJ��mol��1C. ��126 kJ��mol��1D. ��126 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ������з��ĶԶ��ױ���ɫ�ϳ���Ŀȡ���½�չ����ϳɹ�����ͼ��ʾ��

����˵������ȷ����
A. �����ϩ����̼ԭ�ӿ��ܹ�ƽ��
B. ������ˮ����M�ͶԶ��ױ�
C. �Զ��ױ���һ�ȴ�����2��
D. M��ij��ͬ���칹�庬�б����������Ʒ�Ӧ�ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���224LHCl�����ܽ���635mLˮ�У�����������ܶ�Ϊ��1.18gcm��3���Լ��㣺
(1)����������������������ʵ���Ũ���Ƕ��٣�___��___
(2)ȡ����������100mL��ϡ����1.18L��������ϡ��������ʵ���Ũ�ȡ�___
(3)����������Na2CO3��NaOH��Ʒ2.53g������50.0mL2.00molL��1�������У���ַ�Ӧ�����ɱ�״���¶�����̼����112mL����Һ���ԣ��кͶ����������ȥ40.0mL1.00molL��1��NaOH��Һ�������кͺ����Һ�����յõ����ٿ˹��壿___
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com