
分析 由29号为Cu元素,Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si,R的核外L层为奇数,则可能为Li、B、N或F,Q、X的p轨道为2和4,则为C(或Si)和O(或S),又五种元素原子序数依次递增,所以可推出:Q为C,R为N,X为O,Y为Si,
(1)根据处于稳定状态(基态)的原子,核外电子将尽可能地按能量最低原理排布,电子排布遵守最低能量原理,泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况;
(2)根据配位键的形成可知,单方提供孤对电子来分析解答;
(3)根据化学键来分析稳定性,利用分子间作用力来分析气态物质的沸点;
(4)根据非金属性的强弱及电子排布中半满状态来分析;
(5)根据结构式及判断σ键、π键的一般规律来分析解答;
解答 解:由29号为Cu元素,Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si,R的核外L层为奇数,则可能为Li、B、N或F,Q、X的p轨道为2和4,则为C(或Si)和O(或S),又五种元素原子序数依次递增,所以可推出:Q为C,R为N,X为O,Y为Si,
(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9,
故答案为:1s22s22p63s23p63d9;
(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu2+提供空轨道,而形成配位键,
故答案为:孤对电子(孤电子对);
(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4的相对分子质量比CH4大,故分子间作用力大,沸点高,
故答案为:b;
(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si,故答案为:Si<C<N;
(5)C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,C-H之间单键是σ键,C≡C叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,
故答案为:3:2;
点评 本题考查物质结构与性质,明确位置、结构、性质的关系是解答的关键,此题综合性较强,涉及物质结构知识点比较多,考察比较全面,难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:多选题
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-═2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: +CO32-→ +CO32-→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
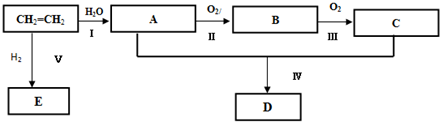
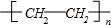 ;反应类型:加聚反应
;反应类型:加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 其反应类型是加聚反应
其反应类型是加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯乙烷跟化合物之间的转化如图所示:
氯乙烷跟化合物之间的转化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
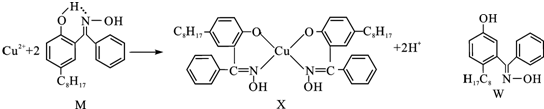
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com