
 .
.分析 (1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键;
(2)NaCN为强碱若酸盐,水解呈碱性;
(3)氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3;
(4)用氯气处理1m3该废水将CN-转化为两种无污染气体,应生成二氧化碳和氮气,结合方程式计算.
解答 解:(1)CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ,故答案为:
,故答案为: ;
;
(2)NaCN为强碱若酸盐,水解呈碱性,离子方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(3)碱性气体为氨气,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的化学方程式为:NaCN+H2O2+H2O=NaHCO3+NH3,
故答案为:NaCN+H2O2+H2O=NaHCO3+NH3;
(4)反应的方程式为:2KCN+5Cl2+4H2O=2KCl+8HCl+N2+2CO2,废水中CN-浓度为26mg•L-1,1m3该废水中n(CN-)=$\frac{1000L×26mg/L×1{0}^{-3}g/mg}{26g/mol}$=1mol,
则需要2.5mol氯气,体积为2.5mol×22.4L/mol=56L.
故答案为:56.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ar原子的结构示意图: | |
| B. | 丙烷分子的比例模型: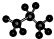 | |
| C. | NaClO的电子式: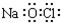 | |
| D. | HCO3-电离方程式:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
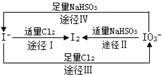
| A. | 由图可知离子还原性的强弱顺序为HSO3->I->Cl- | |
| B. | 足量Cl2能使湿润的淀粉-KI试纸先变蓝后变白 | |
| C. | 途径Ⅱ、Ⅳ反应后溶液的pH均减小 | |
| D. | 途径Ⅲ中若氧化1 mol I-,需消耗67.2L氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有等物质的量的氢氧化钡、明矾两种溶液混合:3Ba2++6OH-+2Al3++3SO42-═3BaSO4+2Al(OH)3↓ | |
| B. | 纯碱溶液与胆矾溶液混合生成正盐、酸式盐、碱式盐:3CO32-+2Cu2++2H2O═2HCO3-+Cu2(OH)2CO3↓ | |
| C. | H218O中投入Na2O2固体:2H218O+2O22-═4OH-+18O2↑ | |
| D. | 0.1mol•L-1CuCl2溶液中加入0.1mol•L-1NaHS溶液:Cu2++HS-═CuS↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液 | B. | 醋酸溶液 | C. | Na0H固体 | D. | 硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、Br- | B. | Ba2+、Na+、OH-、MnO4- | ||
| C. | H+、Na+、NO3-、Cl- | D. | Al3+、K+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com