
【题目】油井发生火灾,产生的大量废气中含有以下成分(①浓烟中的炭粒、②氮的氧化物、③碳的氧化物、④硫的氧化物、⑤碳氢化合物的蒸气),其中对大气造成污染并导致雨水酸化的有害、有毒气体是( )
A. ①③⑤ B. ②④ C. ②③④ D. ②④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
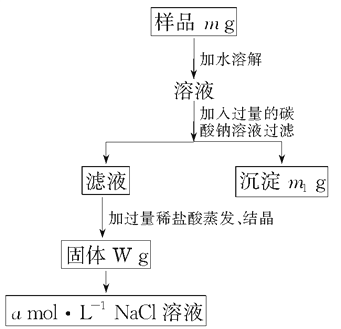
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.3NA
B. 0.1 molL-1 的 FeCl3 溶液中 Cl-的数目为 0.3NA
C. 标准状况下,11.2L 水中含有原子的数目为 1.5NA
D. 1 mol Cl2 与足量的铁反应转移的电子数目是 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气、金属铜和一种氧化物。用下图装置可以实现该反应。

回答下列问题:
(1)A 中发生反应的化学方程式是_____;
(2)B 中加入的物质是____;
(3)实验时在 C 中观察到的现象是______, 发生反应的化学方程式是_______;
(4)实验时在 D 中观察到的现象是出现无色液体,D 中收集到的物质是____,检验该 物质的方法和现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s) + 3CO(g ) + SO2(g) ![]() CaS(s) +3 CO2(g) ΔH=____________。
CaS(s) +3 CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
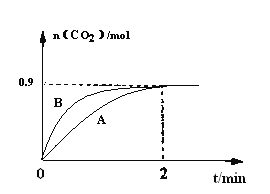
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为__________________。
(4)一定温度下,向恒容密闭容器中加入CaSO4(s)和1molCO,下列能说明反应I和反应II同时发生的是________________(填代号)。
a.反应后气体能使品红褪色
b.反应过程中,CO的体积分数逐渐减小
c.反应体系达平衡前,SO2和CO2两种气体的浓度之比随时间发生变化
d.体系压强逐渐增大
(5)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是__________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是

A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1molNO,可同时得到32gO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com