
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法错误的是( )
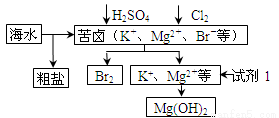
A.试剂1可以选用石灰乳
B.从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2
C.工业上,电解熔融MgO冶炼金属镁可减小能耗
D.可用BaCl2溶液除去粗盐中的SO42-
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:选择题
常温下,向l00mL 0.01 mol?L-1 盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )
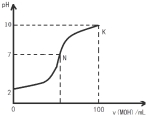
A.MOH是弱碱
B.N点c(Cl-) = c(M+)
C.随着MOH溶液的滴加,比值 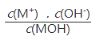 不变
不变
D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436 kJ、243 kJ、432 kJ能量,则由H2与Cl2生成1 mol HCl总的过程需要( )
A.放热185 kJ B.吸热185 kJ C.放热92.5 kJ D.吸热92.5 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.盐酸与碳酸钡反应: CO32-+2H+=CO2↑+H2O
B.向硫酸铜溶液中滴加氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C.向硝酸银溶液中加入铜粉: Ag++Cu=Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:填空题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
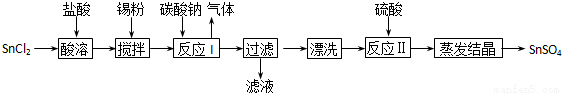
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol?L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:简答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。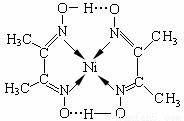
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
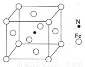
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
下列选项合理的是( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)= 6.8×10 - 4 mol·L-1、 Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)= 6.4×10 - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN溶液 B.HF溶液 C.CH3COOH溶液 D.HNO2溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
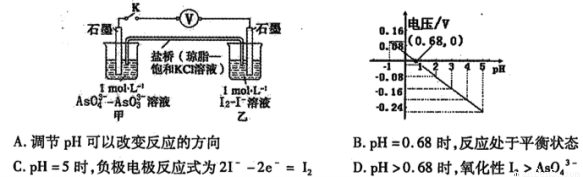
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com