
【题目】下列关于氯化钠晶胞(如图)的说法正确的是( )
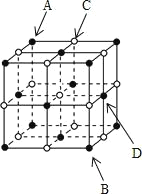
A.每个晶胞含有6个Na+和6个Cl-
B.晶体中每个Na+周围有8个Cl-,每个Cl-周围有8个Na+
C.晶体中与每个Na+最近的Na+有8个
D.将晶胞沿体对角线AB作投影,CD两原子的投影将相互重合
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
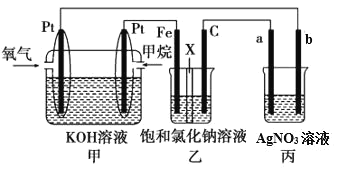
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:_____。
(2)乙中X是交换膜,工作一段时间后若要恢复成原溶液,应_____。
(3)欲用丙装置给铜镀银,b应是_____(填化学式)。
(4)若乙池中的饱和氯化钠溶液换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为_____mol。(忽略溶液体积的变化)
(5)通过膜电池可除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,A极的电极反应为____。
),其原理如图所示,A极的电极反应为____。

(6)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3-的原理如图所示。
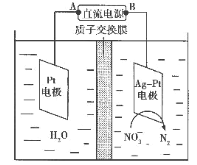
①Ag-Pt电极上的电极反应式为_____。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有固体单质A和淡黄色固体B都能与C反应生成D,同时A与C反应放出单质气体E,B与C反应放出F,E与F在点燃的条件下可以生成C,请回答下列问题:
⑴写出各物质的化学式:
A: ______ B: ______ C: ______D: ______ E: ______ F: ______
⑵写出下列反应方程式:
A与C反应: ______ B与C反应: ______ E与F反应: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
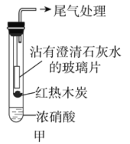
红热木炭未进入试管前,浓硝酸上方并无明显变化。当如图甲连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填选项字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为________。
(2)乙同学设计实验如图乙。
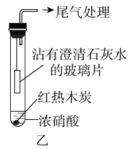
如图乙连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾能将NO、NO2 氧化成 NO3-,MnO4- 被还原为 Mn2+。
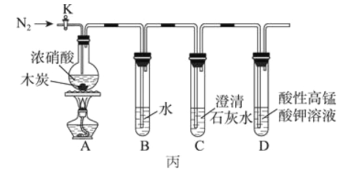
①如图连接装置后,需进行的实验操作为________;加热木炭与浓硝酸前需先通一段时间N2,目的为________________。
②装置A中木炭与浓硝酸反应的化学方程式为_________________________。
③能证明木炭被氧化的实验现象为________________________________________。
④D 装置中发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
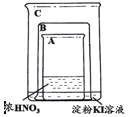
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
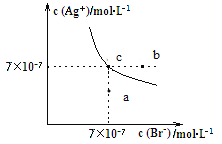
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.每生成1mol氯气,就要转移2mol电子
C.该反应的离子方程式为MnO2+4H++4Cl-![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
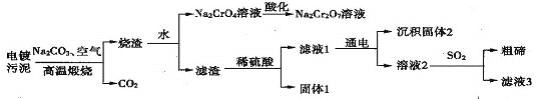
已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4====TeOSO4+H2O。
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4====TeOSO4+H2O。
下列说法错误的是
A. “高温煅烧”电镀污泥时铜、碲和铬元素都被氧化
B. “酸化”时可向溶液中加入硫酸
C. “固体1”的主要成分为Cu
D. “滤液3”可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
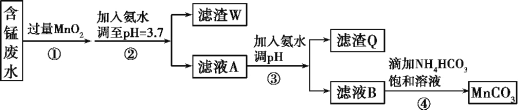
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
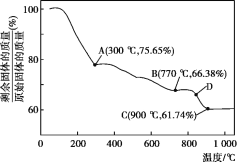
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com