
| A. | 移液时,不慎将液体流到瓶外 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 定容时俯视刻度线和液面 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作,溶液浓度都会偏低,反之偏高;
解答 解:A.移液时,不慎将液体流到瓶外,导致溶质物质的量偏小,溶液浓度偏低,故A选;
B.容量瓶中原有少量的蒸馏水,对n和V都不产生影响,溶液浓度不变,故B不选;
C.容量瓶盛过KOH溶液,使用前未洗涤,导致溶质物质的量偏大,溶液浓度偏高,故C不选;
D.定容时俯视刻度线和液面,导致溶液体积偏小,溶液浓度偏高,故D不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液配制误差分析,准确判断操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
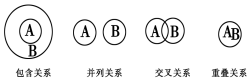
| A. | 化合物与电解质属于包含关系 | |
| B. | 氧化还原反应与化合反应属于包含关系 | |
| C. | 溶液与分散系属于并列关系 | |
| D. | 化合物与碱性氧化物属于交叉关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂虽然不参加化学反应,但能增大单位体积内活化分子的数目,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请根据所学知识回答下列问题:
请根据所学知识回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com