
分析 (1)溶液的pH=2.0,则c(OH-)=10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)计算;
(2)步骤3若未除去Fe3+,则加KI固体时,先发生2Fe3++2I-═2Fe2++I2,后发生2Cu2++4I-═2CuI↓+I2,反应消耗的碘离子的物质的量偏大;
(3)设Cu2S和CuS的物质的最分别为x、y,根据2Cu2+~I2~2S2O32-,利用原子守恒列式求出Cu2S和CuS的物质的量、质量,再求出质量分数.
解答 解:(1)步骤3加入氨水产生沉淀时,溶液的pH=2.0,则c(OH-)=10-12mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则c(Fe3+)=$\frac{2.6×1{0}^{-39}}{{c}^{3}(O{H}^{-})}$=2.6×10-3 mol•L-1,
故答案为:2.6×10-3mol•L-1;
(2)步骤3若未除去Fe3+,则加KI固体时,先发生2Fe3++2I-═2Fe2++I2,后发生2Cu2++4I-═2CuI↓+I2,反应消耗的碘离子的物质的量偏大,所以求出的Cu2+的物质的量将偏高,
故答案为:偏高;
(3)设Cu2S和CuS的物质的最分别为x、y,
根据关系式2Cu2+~I2~2S2O32-可知:n(Cu2+)=n(S2O32-)=0.050 00 mol•L-1×14.00×10-3 L=7.000×10-4 mol,
则:2x+y=7.000×10-4 mol×$\frac{250mL}{25mL}$…①,
Cu2S和CuS被高锰酸钾氧化为CuSO4,Cu、S元素失去电子的物质的量等于Mn元素得到电子的物质的量,
则10x+8y=0.120 0mol•L-1×0.1L×5-0.100mol•L-1×0.016L×$\frac{250mL}{25mL}$…②,
联立方程式①②,
解得:x=2.000×10-3mol、y=3.000×10-3mol,
试样中Cu2S的质量分数为:w(Cu2S)=$\frac{2.000×1{0}^{-3}mol×160g/mol}{0.7500g}$×100%=42.7%,
试样中CuS的质量分数为:w(CuS)=$\frac{3.000×1{0}^{-3}mol×96g/mol}{0.7500g}$×100%=38.4%,
答:Cu2S的质量分数为42.7%,CuS的质量分数为38.4%.
点评 本题考查了物质组成分析与化学综合计算题,涉及氧化还原反应滴定、溶度积的计算等,难度中等,注意运用元素守恒进行推理计算,学习中紧紧抓住元素守恒、质量守恒、电荷守恒、极端分析等化学常用分析方法.


科目:高中化学 来源: 题型:解答题
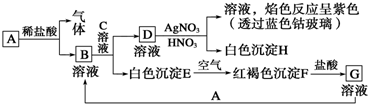
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失电子能力比Na的强 | |
| C. | 砹(At)是第VIIA族,其氢化物的稳定性大于HCl | |
| D. | 第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
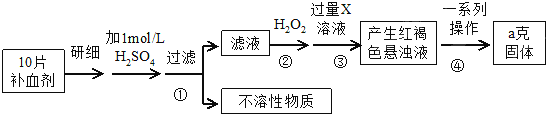
 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种核素 | |
| B. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种元素 | |
| C. | Ir是主族元素 | |
| D. | 由${\;}_{77}^{193}$Ir经过中子辐射后获得${\;}_{77}^{192}$Ir是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com