
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
分析 C2H6完全燃烧生成CO2和H2O,使所有的气体按顺序通过装有无水氯化钙、KOH的硬质玻璃管,无水氯化钙吸收H2O、KOH吸收CO2生成K2CO3和H2O,所以KOH管增加的质量为CO2的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒得n(C2H6)=$\frac{1}{2}$n(CO2)=$\frac{1}{2}$×0.1mol0=0.05mol,根据V=nVm计算乙烷体积.
解答 解:C2H6完全燃烧生成CO2和H2O,使所有的气体按顺序通过装有无水氯化钙、KOH的硬质玻璃管,无水氯化钙吸收H2O、KOH吸收CO2生成K2CO3和H2O,所以KOH管增加的质量为CO2的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒得n(C2H6)=$\frac{1}{2}$n(CO2)=$\frac{1}{2}$×0.1mol0=0.05mol,V(C2H6)=nVm=0.05mol×22.4L/mol=1.12L,故选B.
点评 本题考查化学方程式的有关计算,侧重考查分析计算能力,明确各物质吸收的物质是解本题关键,利用原子守恒进行计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
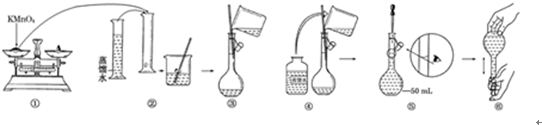
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
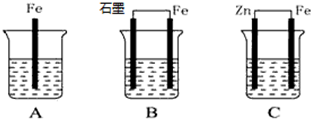
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )| A. | x的数值为2×10-5 | B. | c点时有CaCO3生成 | ||
| C. | 加入蒸馏水可使溶液由d点变成a点 | D. | b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、N的简单离子的还原性:Z2->N- | |
| B. | Y2X和Y2X2都是碱性氧化物 | |
| C. | Z与X形成的化合物对应的水化物一定是强酸 | |
| D. | Z元素的非金属性比N元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | 正交硫比单斜硫稳定 | |
| D. | 单斜硫比正交硫稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com