
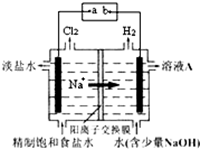
 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.分析 (1)依据装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,和电源正极相连,生成氢气的电极为阴极,和电源的负极相连;
(2)依据装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,a为正极,b为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液;
(3)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式;
(4)根据阳极产物和平衡移动原理分析;
(5)根据热化学方程式的含义和书写方法来回答.
解答 解:(1)装置图中氯气和氢气生成的位置判断,生成氢气的电极为阴极,和电源负极相连,所以电极b是电源的负极,
故答案为:负极;
(2)装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,a为正极,b为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液,
故答案为:NaOH;
(3)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(4)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:Cl2与水的反应为Cl2+H2O?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
(5)1molCl2参与反应时释放出145KJ热量,则反应2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)会放出290KJ的能量,即2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ•mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ•mol-1.
点评 本题考查了电解池原理的分析应用,主要是电极反应,电极判断,热化学方程式的书写,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.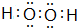 ,用电子式表示Z2M的形成过程:
,用电子式表示Z2M的形成过程: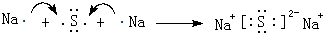 .
.| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 常温下,pH=10的氨水溶液中,由水电离出的c(H+)=10-10mol/L | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
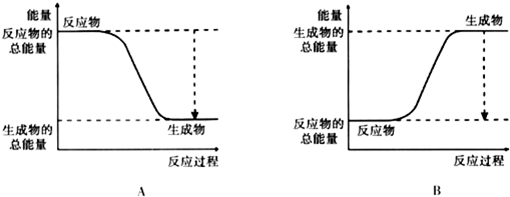
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨 | B. | 氧化铜 | C. | 浓盐酸 | D. | 醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯离子的结构示意图: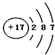 | B. | 18g18O2中含有1mol氧原子 | ||
| C. | 14N和14C是互为同位素 | D. | 氨气的电子式为: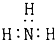 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com